요약췌아세포종은 주로 유년기에 발생하지만, 성인에서도 발생하는 아주 드문 췌장의 종양이다. 성인에서 발생하는 경우 예후가 나쁘지만, 조기 진단 및 수술적 절제가 장기 생존율을 향상시킬 수 있다. 영상학적 검사에서는 고형 유두상 상피성 종양, 관샘암종, 세엽세포암 등을 감별진단에 포함시켜야 한다. 수술적 완전 절제가 원칙이며, 수술후 보조 항암치료 및 항암방사선치료의 경우 아직 연구가 부족한 실정이다. 저자들은 소화불량으로 내원하여 영상학적 검사에서 우연히 발견된 췌장 종괴로 고형 유두상 상피성 종양을 의심 하에 수술을 계획하였고, 수술후 조직학적으로 췌아세포종을 진단하여 보고하고자 한다.
AbstractA blastoma is a type of cancer, which is common in children; it is caused by malignancies derived from in the precursor cells, often called blasts. Examples are nephroblastomas, retinoblastomas, pleuropulmonary blastomas, and pancreatoblastomas. Pancreatoblastomas are extremely rarely in adults. It is difficult preoperatively to distinguish this tumor from other pancreatic tumors including solid and papillary epithelial neoplasm of the pancreas (SPEN), acinar cell carcinoma, islet cell tumor, and ductal adenocarcinoma with cystic degeneration. To our knowledge, this case may be the second report of a pancreatoblastoma occurring in an adult in Korea. We report a case of a pancreatoblastoma that was confirmed by pathology, despite the radiologic finding that assumed it was a SPEN.
서 론췌아세포종은 세엽형, 내분비형, 관형 분화를 보이는 모세포종 또는 배아형 종양이다. 유아기에 드물게 발생하는 췌장 종양으로 비내분비계 종양의 0.5%를 차지한다[1]. 1957년 Becker는 처음으로 보고하면서, “infantile pancreatic carcinoma”로 명명하였다[2]. 이후 1977년 Horie는 조직학적으로 태생기 7주 정도 태아의 췌장조직과 비슷한 종양을 췌아세포종으로 칭하였다[3]. 1986년 Palosaari 등은 성인에서 발생한 췌아세포종을 처음으로 보고하였으며, 현재까지 30여 개의 증례가 보고되었다[4].
증례의 경우 환자는 소화불량을 주소로 병원을 내원하였고, 복부전산화단층촬영 및 자기공명영상에서 췌장 두부의 고형 유두상 상피성 종양이 의심되어 수술을 받았다. 저자들은 영상학적 검사에서 고형 유두상 상피성 종양으로 진단되었으나, 수술 후 조직검사에서 췌아세포종으로 확진된 예를 경험하여 문헌 고찰과 함께 보고하고자 한다.
증 례51세 여자 환자가 내원 3개월 전부터 발생한 소화불량으로 타병원에서 복부전산화단층촬영을 시행하였고, 10 cm 크기의 췌장 두부 종괴가 발견되어 추가적인 평가를 위해 내원하였다. 과거력, 가족력, 음주력, 흡연력에서 특이사항은 없었다.
입원 당시 활력 징후는 혈압 110/80 mmHg, 맥박 66회/분, 호흡수 20회/분, 체온 36.2oC, 의식은 명료하였다. 결막은 창백하지 않았고, 공막 황달은 관찰되지 않았다. 심폐청진에서 심박동은 규칙적이고, 심잡음이 들리지 않았으며, 호흡음은 정상이었다. 복부검사에서 상복부에 압통은 없었으나, 종괴가 촉진되었다.
말초혈액 검사에서 백혈구 8,210/mm3 (호중구 60.3%, 림프구 32.9%), 혈색소 14.5 g/dL, 혈소판 283,000/mm3였다. 혈청 생화학 검사 소견은 아스파르테이트아미노전달효소 28 IU/L, 알라닌아미노전달효소 24 IU/L, 알칼리인산분해효소 75 IU/L, 감마글루탐산탈수소효소 50 IU/L, 아밀라아제 52.7 IU/L, 리파제 38.9 U/L로 정상이었다. 종양 표지자 검사에서도, AFP 1.80 IU/mL, CA19-9 6.75 U/mL, CEA 1.35 ng/mL 모두 정상으로 측정되었다.
복부전산화단층촬영에서 약 10 cm 크기의 췌장 두부에서 기원한 종괴가 관찰되었고, 주췌관은 확장되어 있었다(Fig. 1). 자기공명영상 T1WI에서 출혈을 시사하는 고강도의 병소가 관찰되었고, 조영 증강을 시행했을 때, 종괴는 중 등도의 과다 혈관 양상을 보였다. 전이 병변 및 비정상 림프절은 관찰되지 않았다(Fig. 2). 이러한 소견을 종합해서 고형 유두상 상피성 종양의 가능성을 우선 고려하였고, 세엽세포암, 췌아세포종의 감별이 필요하였다.
환자는 고형 유두상 상피성 종양을 의심 하에 유문 보존 췌장십이지장 절제술을 받았다. 육안소견에서 절제된 종괴는 크기가 9.5×8.7 cm, 피막을 형성하고, 출혈을 동반하였다(Fig. 3A). 현미경 소견에서 아세포 형태의 종양세포가 고형 혹은 선상으로 자라고 있었고, 간질은 비교적 풍부하였다. 또한 아세포 군집 사이에 편평상피양 소체가 산발적으로 관찰되었다(Fig. 3B). 면역조직화학염색에서는 beta-catenin의 nuclear transformation을 보이는 편평상피양 소체를 관찰할 수 있었으며(Fig. 3C), 아세포 형태의 종양 세포는 trypsin, synaptophysin에 양성으로 세엽형, 내분비형 분화를 보임을 알 수 있었다.
환자는 수술 후 조직학적 검사에서 췌아세포종으로 진단받았고, Etoposide/cisplatin 동시항암방사선치료를 시행받은 뒤, 13개월간 재발 없이 추적관찰 중이다.
고 찰췌아세포종은 발생학적으로 췌장에서 기원하는 모세포종으로 세엽형, 내분비형 혹은 관형 분화를 보인다[1]. 대부분의 경우 복부 종괴, 복통, 설사, 체중감소 등과 같은 비특이적인 증상 혹은 방사선학적 검사에서 우연히 발견된다. 종양은 일반적으로 천천히 성장하고, 진단 당시 크기가 매우 크며, 50% 정도 췌장 두부에서 발생하는 것으로 알려져 있다[5,6].
영상학적 검사로 복부 초음파, 복부전산화단층촬영, 자기공명영상 등을 시행할 수 있으며, 진단적 정확도를 높여준다. 복부전산화단층촬영, 자기공명영상에서는 경계가 뚜렷하고, 불균질하며, 중심부 괴사 및 주변부 혈관 분포를 나타낸다[5]. 영상학적 소견의 감별진단으로 고형 유두상 상피성 종양, 세엽세포암, 관샘암종 등을 감별해야 한다. 먼저 고형 유두상 상피성 종양은 대체적으로 크기가 크고, 피막을 형성하고, 고형, 낭형 혹은 석회화 부분을 포함한다. 또한 자기공명영상 T1/T2 강조영상에서 불균질한 신호를 보인다[7]. 세엽세포암의 경우 크기가 매우 크고, 경계가 명확하며, 괴사조직을 포함하기도 하지만, 췌아세포종에 비해 석회화를 동반하는 경우는 드물다[8,9]. 증례에서는 영상학적 소견으로 고형 유두상 상피성 종양을 먼저 고려하였고, 수술 후 조직검사에서 췌아세포종으로 진단되었다. 췌아세포종의 조직학적 특징으로는 편평상피 모양으로 보이는 편평상피양 소체를 관찰할 수 있으며, 본 증례를 포함한 대부분의 경우에서 확인되었다.
성인 환자에서 조직학적 소견에 대한 확인 없이 영상학적 소견으로 췌아세포종을 진단하기는 어렵다. 본 증례에서도 영상학적 검사에서 우연히 발견된 췌장 두부의 10 cm 크기의 종괴에 대해 병력, 유병률, 영상학적 소견 등을 고려하였으나, 술전 진단으로 췌아세포종에 접근하지 못했다. 췌아세포종은 성인에서 평균 생존율이 18.5개월 정도로 소아보다 예후가 나쁜 것으로 알려져 있다. 그래서 술전 진단율을 향상시키는 것이 치료 못지않게 중요하다[10]. 내시경초음파를 통한 가는바늘흡인생검은 방사선학적 소견에 더불어 술전 진단에 도움을 줄 것으로 생각되며, 이에 대한 연구가 더 필요할 것이다. 종양 표지자의 경우, 소아에서 25-55% 정도에서 CEA, AFP 수치가 상승하는 것으로 알려져 있으나, 성인에서는 췌아세포종을 진단하는데 도움이 되지 않는다[11,12].
치료에 관해 살펴보면, Salman 등은 문헌상으로 보고된 췌아세포종의 증례들을 분석하였고(Table 1), 수술을 받은 경우, 수술을 받지 않은 경우에 비해 생존율이 더 높다고 보고하였다. 또한, 수술 단독, 수술후 항암화학치료, 수술후 항암화학방사선치료를 비교하였을 때, 비슷한 생존율을 보였다[13]. Alvise 등은 장기 생존율을 향상시키기 위해 근치적 수술의 중요성을 강조하였고, 수술후 보조 치료의 역할에 대해서는 경험이 부족하여 불명확하다고 하였다[14]. Balasundaramem 등은 현재 자료의 부족으로 가장 적합한 치료 지침이 정립되지는 않았으나, 가능한 수술적 절제를 원칙으로 하였다. 또한, 전이, 재발, 국소절제가 불가능한 경우에는 항암방사선치료를 고려해 볼 수 있다고 하였다[6]. 결론적으로 명백하게 정립된 치료 지침은 없지만, 수술적 절제가 가능한 환자의 경우 완전 절제를 원칙으로 하고, 술후 보조 요법에 대해서는 이견이 존재한다. 또한 완전 절제가 불가능하면, 항암치료 혹은 항암방사선치료를 고려해 볼 수 있으나, 적절한 항암치료요법에 대해서는 제시하지 못하였다. 본 증례에서는 수술후 보조항암방사선치료로 Etoposide/cisplatin 항암 치료를 선택하였고, 항암치료요법의 기준을 마련하는데 도움을 줄 수 있을 것으로 생각된다. 앞으로 다양한 항암치료 용법 중 생존율을 향상시킬 수 있는 요법에 대한 추가적인 연구가 더 필요할 것이다.
REFERENCES2. Becker WF. Pancreatoduodenectomy for carcinoma of the pancreas in an infant: report of a case. Ann Surg 1957;145:864-870.
3. Horie A, Yano Y, Kotoo Y, Miwa A. Morphogenesis of pancreatoblastoma, infantile carcinoma of the pancreas: report of two cases. Cancer 1977;39:247-254.
4. Palosaari D, Clayton F, Seaman J. Pancreatoblastoma in an adult. Arch Pathol Lab Med 1986;110:650-652.
5. Kohda E, Iseki M, Ikawa H, et al. Pancreatoblastoma. Three original cases and review of the literature. Acta Radiol 2000;41:334-337.
6. Cantisani V, Mortele KJ, Levy A, et al. MR imaging features of solid pseudopapillary tumor of the pancreas in adult and pediatric patients. AJR Am J Roentgenol 2003;181:395-401.
7. Balasundaram C, Luthra M, Chavalitdhamrong D, Chow J, Khan H, Endres PJ. Pancreatoblastoma: a rare tumor still evolving in clinical presentation and histology. JOP 2012;13:301-303.
9. Klöppel G, Maillet B. Classification and staging of pancreatic nonendocrine tumors. Radiol Clin North Am 1989;27:105-119.
10. Klimstra DS, Wenig BM, Adair CF, Heffess CS. Pancreatoblastoma: a clinicopathologic study and review of the literature. Am J Surg Pathol 1995;19:1371-1389.
11. Imamura A, Nakagawa A, Okuno M, et al. Pancreatoblastoma in an adolescent girl: case report and review of 26 Japanese cases. Eur J Surg 1998;164:309-312.
12. Vannier JP, Flamant F, Hemet J, et al. Pancreatoblastoma: response to chemotherapy. Med Pediatr Oncol 1991;19:187-191.
Fig. 2.(A) T1-weighted magnetic resonance (MR) imaging shows hyperintensity foci. (B) T1-weighted magnetic resonance (MR) enhanced imaging showed moderately hypervascular pattern. 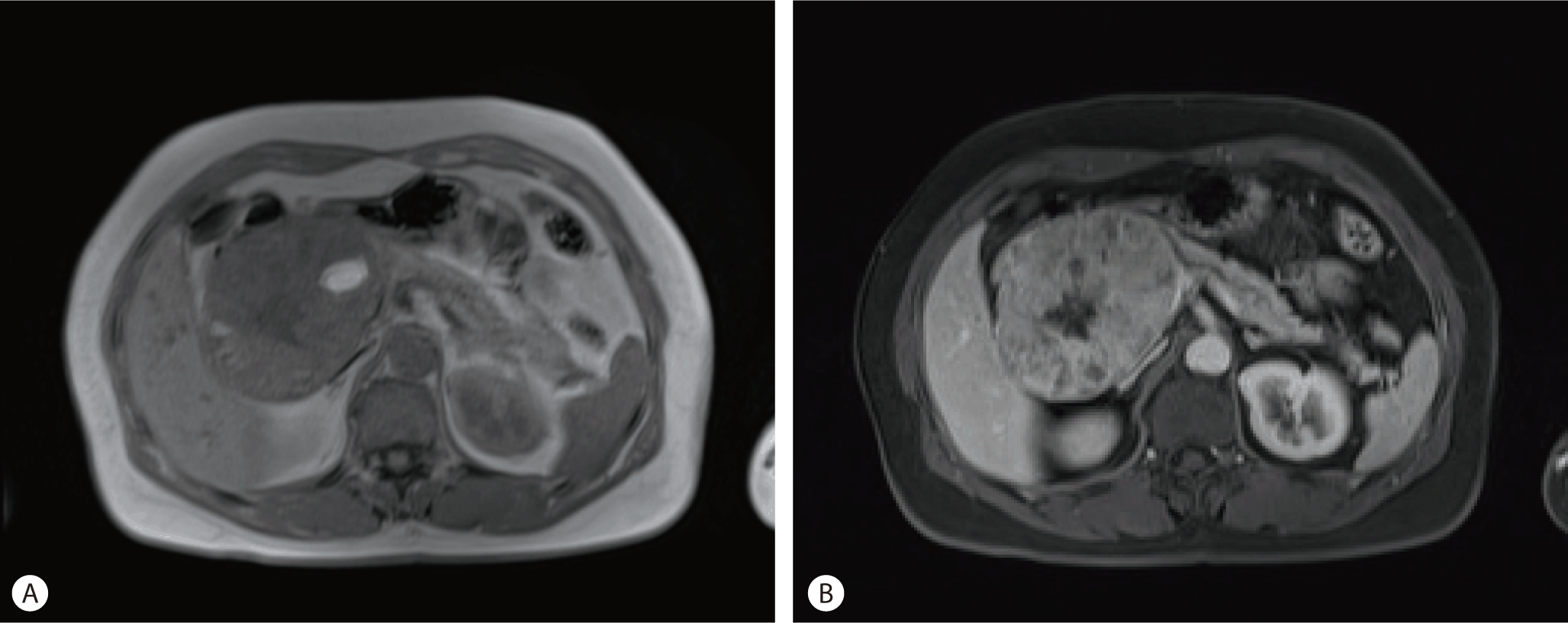
Fig. 3.(A) Cross section of tumor shows a yellowish, well-circumscribed mass with focal hemorrhagic change. (B) Tumor cells look like blasts and grow sold pattern or cord pattern. Histologic section of tumor contains scattered ‘‘squamoid corpuscles’’ (HE ×400). (C) By immunohistochemistry, cells were positive for beta-catenin (beta-catenin, ×400). 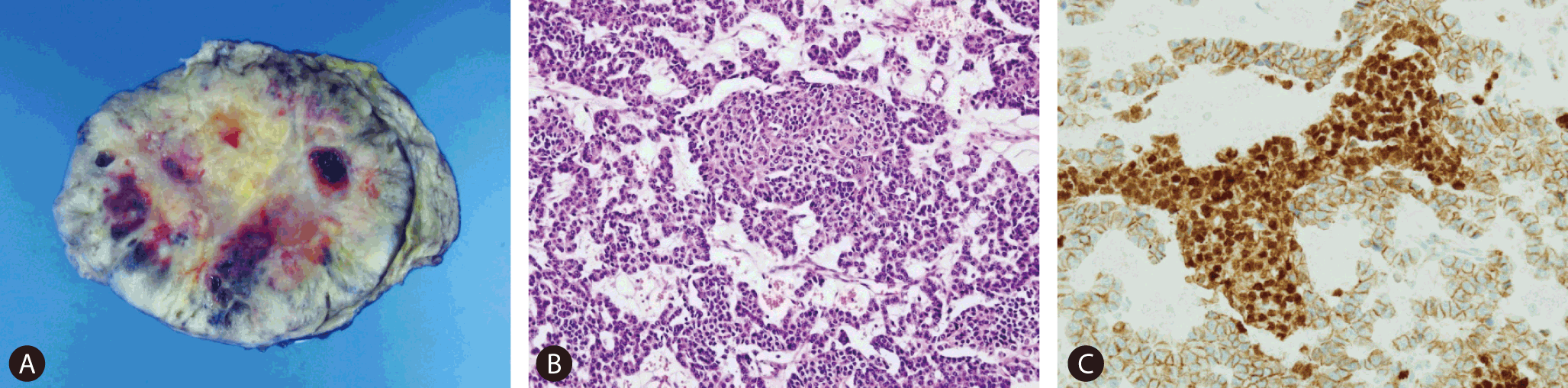
Table 1.Mean characteristics, tumor location, size, therapy, and outcome reported in the literature[7] adj., adjuvant; CD, choledoc; DOD, dead of disease; EBRT, external beam radiation therapy; IORT, intraoperative radiation therapy; LN lymph nodes, met., Metastases; NED, no evidence of disease; neoadj., neoadjuvant; PV, portal vein; SMA superior mesenteric artery, SMV, superior mesenteric vein; GIB gastrointestinal bleeding. 5-FU, 5-flourouracil. |
|
||||||||||||||||||||||||||||||||||||||