서 론
구역성 췌장괴사(walled-off pancreatic necrosis, WOPN)는 급성 괴사성 췌장염에 의해 발생하는 액체와 고형 찌꺼기가 가성낭종과 같이 육아조직에 의한 벽으로 둘러싸이는 것을 의미한다. WOPN은 사망률과 이환율이 매우 높은 질환이기 때문에 전통적으로 외과적인 괴사 조직 제거가 중요한 치료법이었으나, 개복 수술시 회복기간이 길고 피부와 누공이 발생하기 쉬우며, 탈장 등이 합병증으로 발생할 수 있다. 내시경적 괴사제거술은 1996년 최초로 보고된 이래 점차 임상에 적용되면서 기존의 외과적 제거술에 비해 임상 호전율이나 합병증 측면에서 더 우수한 것으로 알려져 있다[1]. 내시경적 괴사제거술이 외과적 제거술에 비해 전신적 염증 반응 증후군으로의 진행을 낮추고, 국소적인 병변 합병증의 발생률이 적은 것으로 보고되었다[2,3].
베르니케뇌병(Wernicke encephalopathy)은 티아민(thiamine) 결핍이 원인으로 알려져 있으며 안구진탕, 의식변화, 보행실조의 세 가지 주 증상을 특징으로 하는 급성 대사성 뇌 병증으로 흔히 알코올 섭취와 관련되어 발생하나 영양실조, 위장관 수술, 알코올 중독 등이 주요한 위험원인이다[4].
저자들은 급성 괴사성 췌장염 환자에서 발생한 감염성 WOPN를 반복적인 내시경적 괴사제거술을 시행하던 중, 티아민 결핍으로 베르니케뇌병이 발생하여 내과적으로 성공적으로 치료한 1예를 문헌고찰과 함께 보고하는 바이다.
증 례
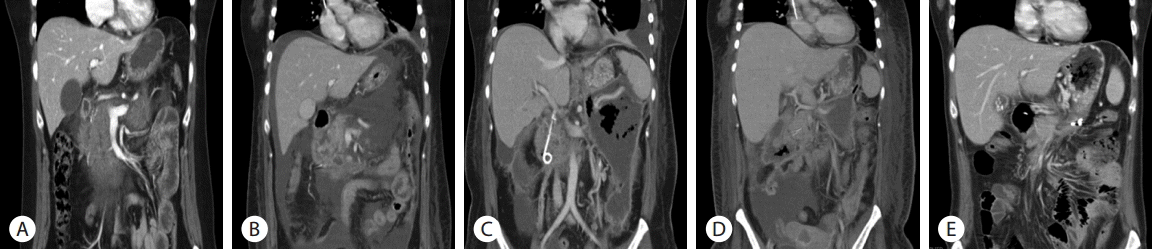
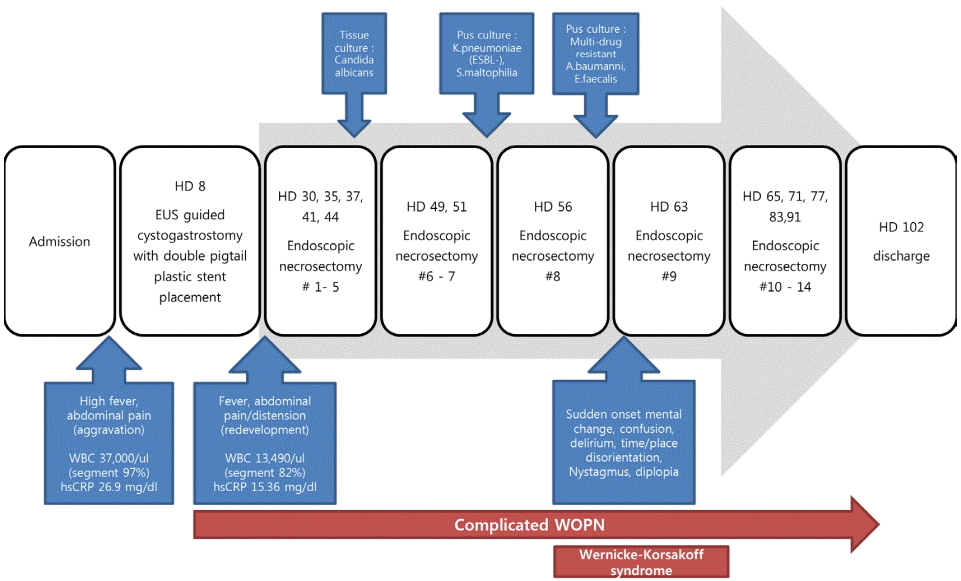
47세 여자가 2일 전 발생한 상복부 통증을 주소로 응급실에 내원하였다. 복통은 배가 딱딱해지는 듯한 양상이었으며 2일전 과식한 후 복부 불편과 구역이 발생하였고 1일 전 증상이 악화되었다. 약물 복용력 및 특별한 기저질환은 없었고, 매달 1-2회 소주 1병 음주력이 있고 흡연력은 없었다. 내원 당시 급성 병색을 보였으며, 생체징후는 혈압 80/50 mmHg, 맥박 80회/분, 호흡수 20회/분, 체온 36.8°C였다. 일시적인 혈압 저하로 정맥 수액공급을 시행하였으며 신체검진에서 복부가 약간 신전되어 있었고, 장음이 저하되어 있었으며 전반적인 복부 압통과 반발 압통을 심하게 호소하였다. 말초혈액검사에서 백혈구 24,590/mm3 (호중구 75.4%, 림프구 16%, 단핵구 7.5%), 혈색소 15.6 g/dL, 혈소판 457,000/mm3 였다. 일반 생화학검사에서 아스파트산아미노기전달효소(AST) 21 U/L, 알라닌아미노기전달효소(ALT) 14 U/L, 알칼리성인산염분해효소(ALP) 76 IU/L, 총 단백 7.3 g/dL, 알부민 4.5 g/dL, 총 빌리루빈 1.3 mg/dL, 혈중 아밀라아제(amylase) 7,414 U/L, 리파제(lipase) > 15,000 U/L로 확인되었고 C-반응단백이 0.16 mg/dL로 확인되었다. 단순 흉부 방사선 사진에서 이상소견은 없었고, 복부 컴퓨터 단층촬영에서 담낭담석이 관찰되었으며 광범위한 췌장 주위 부종과 췌장의 간질성 염증소견, 소량의 복수가 관찰되었다(Fig. 1A). 입원 당시 Ranson’s score 2점, APACHE-2 score 13점, BISAP(bedside index of severity in acute pancreatitis) score 0점이었고 애틀랜타 분류 개정안(revised atlanta classification)에 따라 중증 급성 췌장염으로 진단하여 중환자실에서 집중치료를 시행하였다.
입원 1일째 췌담도 초음파 내시경(endoscopic ultrasound)을 통하여 총담관 미세결석들과 찌꺼기, 담석을 확인하였고 이후 내시경 역행성 담췌관조영술(endoscopic retrograde cholaniopancreatography)을 시행하고 내시경하 유두괄약근절개술(endoscopic sphincterotomy)과 총담관의 미세결석제거술을 시행하였다.
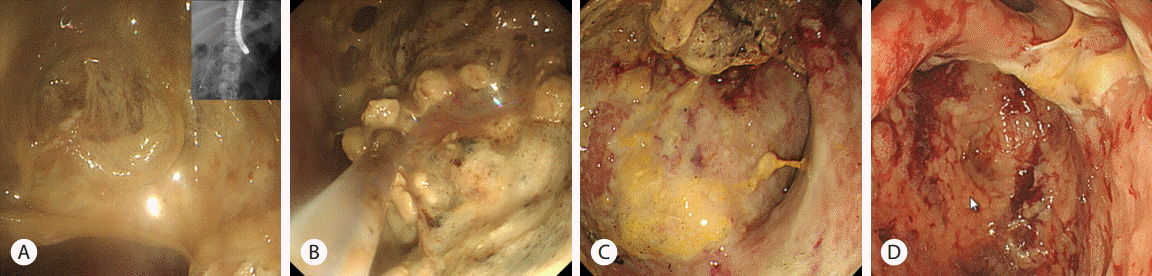
내시경 역핵성 담췌관조영술 시행 후 환자의 복통은 감소된 양상이었으나, 입원 8일째 39.4°C의 발열과 복통이 악화되었으며 백혈구증가증이 지속되어 추적 췌장 컴퓨터 단층 촬영을 시행하였다(Fig. 1B). 급성 괴사성 췌장염의 세균 감염을 의심하여, 초음파 내시경하 낭종 흡인 검사를 시행하였다. 흡입된 액체는 검붉은 색의 매우 혼탁한 삼출물로 플라스틱스텐트를 이용하여 초음파 내시경 유도하 낭위연결술(endoscopic ultrasound guided cystogastrostomy)을 통해 감염성 삼출액의 배액을 시행하였다. 이후 복통과 발열은 완화되는 양상이었고 백혈구 증가도 호전되는 양상이었다. 입원 25일째 발열과 백혈구증가증을 동반한 복통이 다시 발생하였고, 복부 팽만이 나타났다(Fig. 1C). 신체검진상 압통과 반발압통이 관찰되어 추적 췌장 컴퓨터단층촬영을 시행하였으며 췌장 갈고리돌기(pancreas uncinate process)의 일부를 제외하고 췌장 전체에 구역성 괴사를 확인하여, 입원 27일째, 낭위연결술를 추가로 시행하고, 위체부 상단 후벽을 통해 추가 플라스틱스텐트를 삽입하였다(Fig. 2A). 스텐트 삽입 이후로 점도가 매우 높고 혼탁한 노란색의 농이 배액이 되는 것을 확인할 수 있었다. 입원 29일째, 스텐트 삽관 부위를 풍선 카테터 이용해 15 mm로 확장하여 첫번째 내시경적 괴사제거술(endoscopic necrosectomy)을 시행하였다. 여러 번의 내시경적 괴사제거술을 시행하는 동안, 비교적 낮은 발열과 적은 복통을 호소하였으며, 내시경적 괴사제거술 이후 전신 증상이 호전되고 발열이 호전되었으나, 괴사제거술을 시행하지 않는 동안은 환자의 컨디션이 저하되고, 괴사제거술을 시행하면 호전을 반복하여 괴사제거술을 일주일에 2번 씩 총 7회까지 고정적으로 시행하였다(Fig. 2B). 배액된 농의 배양검사 결과 Candida albicans, multi-drug resistant Acinetobacter baumanni와 Enterococcus faecalis가 동정되어 항생제 감수성 결과에 따라 항생제와 항진균제를 투여하였다. 지속적인 괴사제거술을 시행한 이후로, 내부에 괴사물질과 농은 점점 깨끗해졌고 괴사 강 내 육아조직이 가득 찬 양상으로 관찰되었다(Fig. 3C). 환자의 증상은 점차 호전되어 일주일에 두 번 시행하던 괴사제거술을 총 8회째부터 14회까지 일주일에 한번으로 점차 간격을 연장했다.
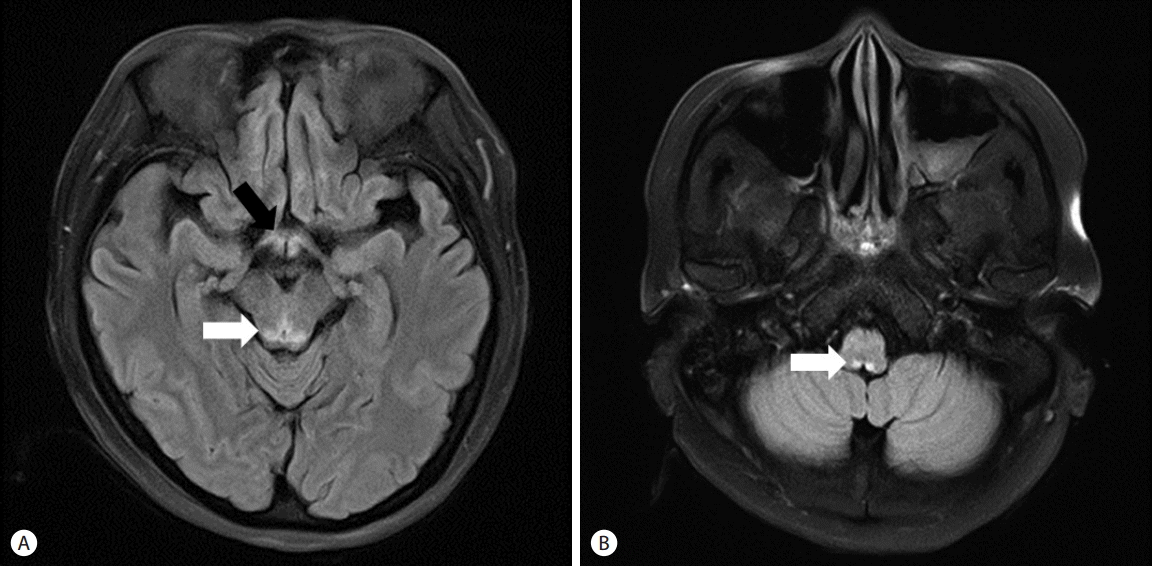
의료진은 급성 췌장염 급성기 이후, 입원 13일째부터 환자에게 지속적인 경구 영양 섭취를 권하였으나, 환자는 구토 및 식욕 부진으로 식사를 제대로 하지 못하였으며, 충분한 영양 공급을 위해 지속적인 총정맥영양 공급 치료를 시행하였다. 환자의 전신 컨디션이 호전되던 중 입원 56일째 갑자기 복시를 호소하였다. 입원 61일째 화장실에 걸어가기 힘들어 하면서 갑자기 의식변화가 관찰되고, 착란과 시간에 대한 지남력이 소실되었다. 입원 62일째 화를 지속적으로 내고, 사람, 장소에 대해 지남력 장애가 유발되었으며, 조음장애, 눈동자 운동장애 등이 발생하였다. 신경학적 진찰에서 수평안구진탕이 관찰되었으나 동공반사는 정상이었고 말초혈액 상 티아민 53.0 nmol/L (정상치 59.0-213 nmol/L) 측정되었 다. 뇌 자기공명영상 검사를 시행하였으며 fluid attenuated inversion recovery (FLAIR) 영상에서 등쪽 중뇌(dorsal mid-brain), 양쪽 내측시상(bilateral medial thalami), 등쪽 연수(dorsal medulla oblongata)에 고신호강도가 관찰되어 임상 증상과 영상소견으로 베르니케뇌병을 진단하였다(Fig. 3). 입원 63일째, 티아민 500 mg 3일, 250 mg 5일, 이후 100 mg 감량 유지하였으며 티아민 투약 3일째부터 지남력이 회복되기 시작하였고 지속적인 내시경적 괴사제거술을 유지하였다(Fig. 2D). 입원 102일째 환자는 복통과 의식변화 증상이 호전되어 티아민 투약을 중단하고 퇴원하였다(Fig. 4).
퇴원 한달 후, 추적 컴퓨터 단층촬영에서 구역성 괴사는 크기가 많이 감소되었고 췌장 두부로 남아 있던 실질의 염증도 호전된 소견을 볼 수 있었다(Fig. 1E). 여전히 담낭의 담석이 남아 있어 재입원하여 총담관 및 췌관에 삽입되어 있었던 플라스틱스텐트를 전부 제거하고 복강경으로 담석을 동반한 담낭을 제거하려 하였으나 복강내 유착이 심하여 개복술로 수술을 시행하였다. 그 후 12개월 외래 추적관찰에서도 췌장염 및 베르니케뇌병의 재발 없이 건강하게 지내고 있다.
고 찰
급성 췌장염은 췌장 실질의 괴사가 동반되는 염증성 질환으로 발병 시점에 따라 4주 이내이고 막이 없는 급성 괴사성 저류(acute necrotic collection)와 발생 4주 이후에 췌장 및 주변 지방의 괴사가 융합되어 섬유화 조직으로 싸여있는 구역성 괴사로 나누어 진다[5]. 구역성 괴사가 만들어지면서 이로 인한 폐색 증상이 생기거나 이차적인 감염이 발생하는 경우 내시경적 배액술에 대해 경험이 축적됨에 따라 내시경적 괴사제거술을 시행하면 성공률은 68-93%로 보고되었다. 평균적으로 괴사 조직이 완전히 소실되는 데까지는 4.1개월이 소요되었으며 내시경적 괴사제거술은 3회 시행하였다[6,7].
구역성 괴사는 사망률과 이환율이 매우 높은 질환이기 때문에 전통적으로 외과적 괴사제거술이 권장되었으나 외과적 괴사제거술은 회복기간이 길고 반복적인 시술이 필요하고, 피부와 누공이 발생하기 쉬우며 탈장이 합병증으로 발생할 수 있다는 단점이 있다. 경피적 배액술 또는 경피적 괴사제거술이 수술을 대체하는 방법으로 논의되었으나 치료효과의 차이가 크게 보고되고, 경피적 배액관이 세균의 집락화(colonization)의 원인이 되기도 하는 문제점이 보고되면서, 임상적 호전율이나 합병증 측면에서 내시경적 괴사제거술이 우수한 것으로 알려져 있다. 내시경적 괴사제거술은 피부 절개가 없어 반복적인 시술에도 환자에게 부담을 주지 않으며, 전신 마취가 필요하지 않아 치료 내시경 수준의 의식하 진정만으로 시술이 가능하고 중환자실에서도 시술이 가능하다는 장점이 있어 환자 상태가 어려운 경우에도 시술을 시행할 수 있다[1,8-10].
단, 내시경적 괴사제거술의 경우, 내시경적 접근이 가능해야 하므로 괴사 조직이 접근 가능한 위치 즉 십이지장 후복강이나 신장주위 복강에 있어야 하며, 합병증으로는 감염, 출혈, 천공, 공기 색전증 등이 보고되었다[11]. 무엇보다도 괴사 조직을 내시경으로 제거하는 도중 비동맥 파열로 사망한 증례와 같이 치명적인 합병증이 발생할 수 있기 때문에 시술자의 숙련도가 중요하며 괴사조직을 무리하지 않고 안전성을 고려하여 제거해야 한다. 경험이 많고 숙련된 내시경 전문의가 시행하는 것이 중요하고 내시경 시술이 어려울 경우 무리한 시술을 진행하지 않고 외과 및 중재적 방사선 치료 전문의와의 긴밀한 협력을 통해 경피적 배액술이나 수술적 치료를 전환하는 것을 항상 고려해야 한다[10]. 본 증례의 경우에도 외과적 괴사제거술을 고려하여 외과의와 협의 진료를 하였으나, 악화된 환자 컨디션과 높은 합병증 이환율로 내시경적 괴사제거술을 일차로 시행하였다. 특히 본 환자는 배액된 농의 배양검사 결과 Candida albicans, imipenem resistant Acinetobacter baumanni와 Enterococcus faecalis 동반 감염이 발생하여 항생제, 항진균제 치료와 더불어 내시경적 괴사제거술이 더 효과적이었다.
베르니케뇌병은 티아민(vitamin B1)의 부족으로 인하여 발생하는 급성 뇌 손상으로 초기에는 가역적이나 사망률이 17-20% 정도에 이르는 내과 응급 질환이며, 장애가 만성화될 경우 Wernicke-Korsakoff 증후군이라고 한다[4]. 티아민은 탄수화물대사에 주요한 조효소로 보충 없이 18일 이상이 경과하면, 체내 저장량이 고갈된다는 보고도 있지만, 금식과 활동량이 저하된 상태에서는 에너지원으로 탄수화물이 아닌 지방을 사용하기 때문에 6주 이상이 지나도록 티아민 결핍이 발생하지 않는 경우가 많다[12]. 그러나 티아민 저장량이 부족할 것으로 추측되는 환자의 경우에는 탄수화물 공급을 증가시킬 때 베르니케뇌병이 발생한다. 티아민의 부족은 만성적인 음주 때문에 경구 섭취가 불량한 경우에 주로 발생하며, 정상적인 섭취를 하더라도 흡수장애가 있는 경우 발생할 수 있다. 알코올과 상관없는 베르니케뇌병 환자의 발생 원인을 1889년부터 2014년까지 증례보고를 분석한 문헌에 따르면, 소화기계통에 질병을 앓고 있거나 소화기계 수술을 시행한 경우(34%), 임신입덧(18%), 기아(17%), 백혈병이나 림프계 악성질환(6%), 경정맥 수액으로 식사를 대체하는 경우(5%) 등으로 유발되는 것으로 나타났다[13]. 급성 췌장염의 경우 치료의 목적으로 실시하는 장기간의 금식과 정맥영양치료에서 티아민의 공급이 적절하지 못할 수 있고, 알코올성 췌장염 환자의 경우에는 알코올 장기복용에 의한 티아민의 흡수장애도 있을 수 있다[14]. 본 환자의 경우에는 입원 후 치료를 위해 금식과 총 정맥 영양공급을 계속하고 맑은 유동식의 섭취와 금식을 반복하였는데 충분한 음식을 통한 영양섭취를 하지 못하여 췌장염이 환자에게 베르니케뇌병을 유발한 것으로 짐작된다. 티아민은 신경전달에 중요한 역할을 하므로 부족하면 신경 손상을 유발하고, 말초 신경병증이 흔히 발생할 수 있으며 자율신경계에 손상이 있는 경우 기립 저혈압, 실신, 빈맥, 저체온증, 배뇨장애 등이 유발되기도 한다[4]. 베르니케뇌병은 안구운동이상(ophthalmoplegia), 운동실조(ataxia), 의식의 변화가 있을 때 의심하고 진단할 수 있다. 베르니케뇌병이 의심되면 적어도 하루에 500 mg 이상의 thiamine을 투여한 후에 하루 150-300 mg으로 감량하여 경구 혹은 비경구로 약 1-2주 정도 지속해서 투약하여 치료를 시행한다[15]. 가장 중요한 것은 예방과 조기 진단인데 예방법은 탄수화물 투여 전에 티아민을 공급하는 것이다. 급성 신경학 증상은 티아민 정주로 호전될 수 있으나 약 80%는 만성적으로 신경학적 후유증이 남을 수 있고 이 중 25%는 비가역적이다[4]. 본 증례는 중증 급성 췌장염 환자에서 경험적인 항생제 치료 등 보존적인 치료를 시행했음에도 불구하고 거대한 구역성 괴사가 발생하고, 감염성 괴사성 췌장염으로 진행하여 내시경적 괴사제거술을 14번 시행하였으며 치료 도중 베르니케뇌병이 발생한 경우로 성공적으로 치료를 경험한 예이다. 본 증례의 경우 지속적인 경구 영양 섭취 권유에도 불구하고 전신 컨디션 저하와 구역, 구토, 우울감 등의 증상을 호소하며 식사를 지속적으로 시행하지 못하였으며 베르니케뇌병이 발생한 경우였다. 내시경적 췌장 괴사제거술의 반복적인 시행과 같이, 장기간 금식을 요하거나 금식이 길어질 경우 예방적으로 티아민을 투여하는 것이 감염성 췌장 괴사 환자의 치료에 도움이 될 수 있을 것이다.