서 론
다발내분비샘종양1형(multiple endocrine neoplasia type 1, MEN1)은 염색체 1번에 있는 종양억제 유전자인 MEN1 유전자의 돌연변이로 인해 상염색체 우성으로 유전되는 드문 질환이다[1]. 임상적으로 뇌하수체, 부갑상샘 및 췌장에 내분비 종양을 2개 이상 동반하는 경우 진단할 수 있다[1]. MEN1과 관련된 사망에 가장 중요한 요소는 동반 종양의 악성 및 전이 여부이다[2,3]. 췌장의 신경내분비종양(neuroendocrine tumor, NET)은 30-80% 동반되며, 증상이 있거나 악성 가능성이 있으면 수술적 절제가 치료에 있어 가장 중요하다[2,3]. 하지만 수술을 거부하거나, 여러 동반질환으로 인해 수술이 불가능한 경우 혹은 종양의 크기가 작은 경우에는 초음파 내시경을 통한 치료가 한 방법으로 고려되고 있다[4-7]. 저자들은 33세의 여자 환자에서 다른 내분비 종양의 치료와 함께, 췌장 NET에 대해 초음파 내시경 유도하 에탄올 주입술(endoscopic ultrasonography-guided ethanol injection, EUS-EI)을 시행한 경험에 대해 문헌과 함께 보고하는 바이다.
증 례
33세 여자 환자로, 내원 1개월 전 타원에서 폐렴으로 치료 중에, 멍이 잘 들고, 털이 많아 쿠싱증후군이 의심되어 시행한 영상검사에서 부신과 췌장 및 갑상선에 종양이 확인되어 내원하였다. 고혈압으로 irbesartan, dichlozid, nifedipine 복용중이었다. 어머니와 삼촌이 MEN1 진단받은 가족력이 있으며, 어머니는 부갑상샘절제술 및 먼쪽 이자절제를 시행받았고, 삼촌은 췌장을 전절제하였다.
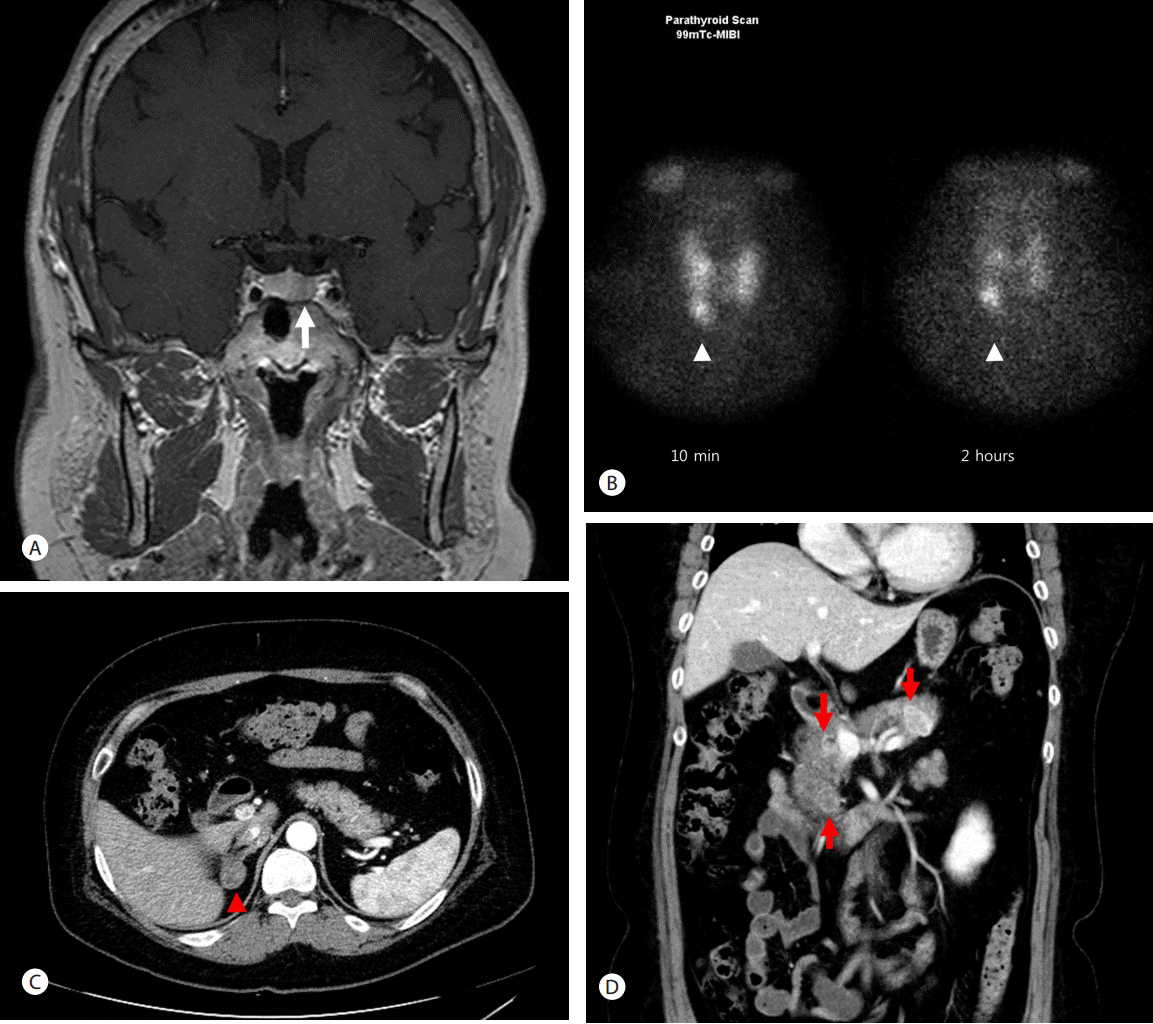
활력 징후는 혈압 127/94 mmHg, 심박수 86/min, 호흡수 18/min, 체온 36.7℃였고, 체중 83.6 kg, 신장 163 cm, 체질량 지수 31.47 kg/m2로 비만하였다. 달덩이얼굴이었으며, 팔다리 및 복부에 다모증이 확인되었다. 의식은 명료하였고, 갑상선 및 복부 촉진상 이상소견은 없었다. 24시간 소변 유리 코티졸은 277 µg/day (20-70 µg/day)로 상승해 있었으며, 한밤중 혈청 코티졸 역시 19.6 µg/dL (0-10 µg/dL)로 상승되어 쿠싱 증후군에 합당하였다. 혈장 부신피질 자극호르몬(adrenocorticotrophic hormone, ACTH)은 16.5 pg/mL (6-76 pg/mL)로 억제되지 않았기에 ACTH 의존 쿠싱증후군을 시사하였다. 고용량 덱사메타손 억제검사에서 혈청 코티졸이 15.4 µg/dL(5-25 µg/dL)에서 3.3 µg/dL로 억제되었으며, 뇌 자기공명검사에서 1 cm의 뇌하수체 종양이 확인되었다(Fig. 1A). 또한 뇌하추체 정맥동검사에서 ACTH 수치가 말초혈액과 비교하여서 코르티코트로핀분비호르몬(corticotropin-releasing hormone, CRH) 투약 전 2배 이상, CRH 투약 후 3배 이상 높아 뇌하수체 선종에 의한 쿠싱병으로 진단하였다. 기능성 뇌하수체 종양에 대해, 나비뼈 경유 접근법(transsphenoidal approach, TSA)으로 좌측 뇌하수체를 절제하였고, 최종적으로 ACTH 면역형광염색 양성의 0.5 cm 크기의 뇌하수체 선종으로 확인되었다.
환자는 혈액검사에서 혈장 칼슘이 11.4 mg/dL (8.7-10.2 mg/dL)로 증가되어 있었으며, 부갑상샘 호르몬(parathyroid hormone, PTH) 역시 183 pg/mL (8-51 pg/mL)로 상승되어 있었다. 또한 부갑상샘 스캔에서 우측하부 부갑상샘에서 흡수 증가가 확인되어 부갑상선 기능항진증으로 진단하였다(Fig. 1B). 이와 함께 좌측 갑상선 분절에 악성 결절이 동반되어 있어, 좌측 갑상선절제술 및 좌측 상부와 우측 상하 부갑상 샘절제술을 시행하였다. 조직검사 결과 갑상선 유두암 및 부갑상샘 과형성이 확인되었고, 수술 후 PTH 20.2 pg/mL, 칼슘 8.5 mg/dL로 호전되었다.
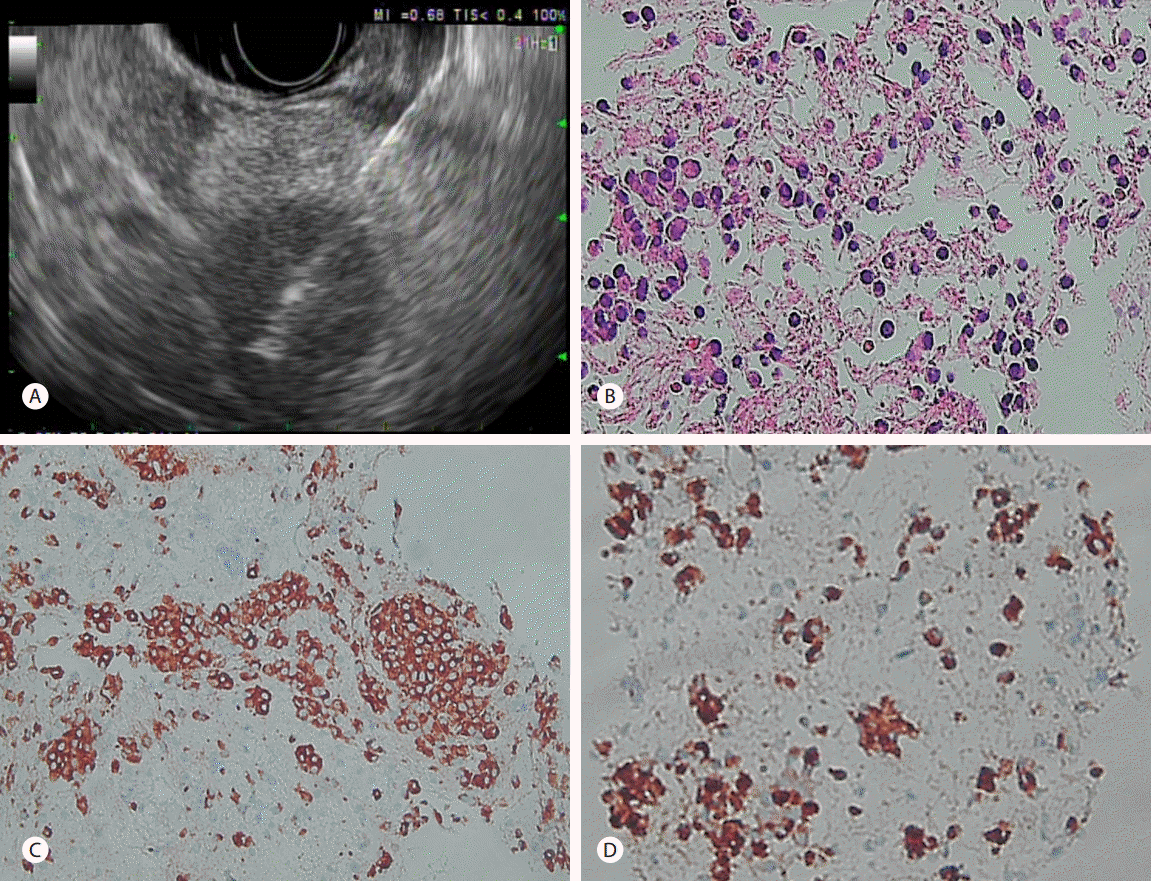
복부 전산화단층촬영에서는 2.4 cm의 부신 종양(Fig. 1C)과 함께 다발성의 췌장종양(Fig. 1D)이 관찰되었다. 부신 종양은 호르몬 검사에서 24시간 소변 메타네프린 40.7 µg/day(30-350 µg/day), 24시간 소변 노르메타네프린 345.1 µg/day(50-650 µg/day), 디히드로에피안드로스테론 황산염(dehydroepiandrosterone-sulfate) 31.0 µg/dL (10-619 µg/dL)로 정상 범위를 보여 비기능성 종양 진단 하에 경과 관찰하기로 하였다. 췌장종양은 두부에서 미부까지 분포하였고, 이 중 체부의 2.4 cm 종양에 대해 초음파 내시경 유도하 흡인생검(endoscopic ultrasonography-guided fine needle aspiration, EUS-FNA)을 시행하였다(Fig. 2A). 면역형광염색에서 synaptophysin, chromogranin 및 e-cadherin 양성으로 확인되어 췌장 NET로 진단되었다(Fig. 2B-D). EUS-FNA는 선형배열 초음파 내시경(GF-UE206; Olympus Medical System, Tokyo, Japan)과 22 gauge 세침(Echotip ProCore; Cook Endoscopy, Winston-Salem, NC, USA)을 이용하여 시행되었다. 혈장 가스트린 40 pg/mL (0-90 pg/mL)였고, 저혈당 등의 증상은 없어 비기능성 췌장 NET로 판단하였다.
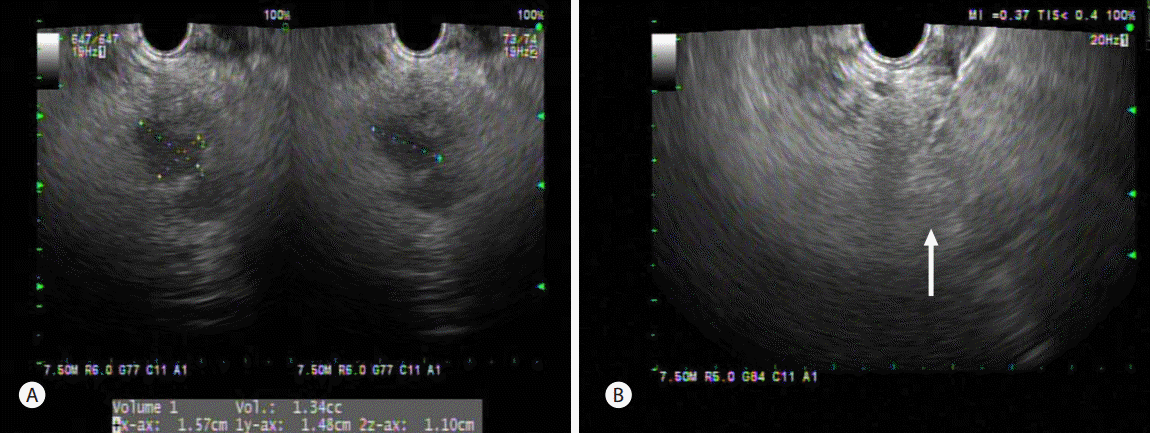
췌장 기능 보존을 위해 두부의 병변은 EUS-EI 시행하고, 췌장 미부 병변은 절제하기로 계획하였다. EUS-FNA와 동일한 세침을 이용하여 에탄올 주입술을 시행하였다. 상절치에서 53 cm 부위에서 췌장의 경부를 관찰하였을 때, 1.6 × 1.5 × 1.3 cm의 병변이 관찰되어 에탄올과 리피돌 1:1 혼합용액을 3.8 mL 주입하였고, 이후에도 주변부 조영 증강이 확인되어 추가로 3.3 mL 주입하였다(Fig. 3A, B). 시술 중 NET와 췌관과의 연결이 의심되어 시술 후 췌장염 발생 가능성이 있을 것으로 판단하였다. 추가적으로 상절치에서 60 cm에서 갈고리 돌기를 관찰했을 때 1.3 × 1.5 cm의 병변이 관찰되어, 이에 대해 에탄올과 리피돌 혼합용액을 3.0 mL 주입하였다(Fig. 3C, D). 시술 당일 복통 및 발열과 함께 아밀라제 806 U/L, 리파제 3844 U/L로 급성 췌장염이 발생하였다. 3일 뒤 시행한 전산화 단층촬영에서 급성 췌장염 소견과 함께 췌장 두부 및 경부의 시술 병변에서 리피돌에 의한 고음영이 병변이 관찰되었다. 이와 함께 십이지장 및 원위부 췌장과 주췌관 내부에도 시술 용액의 누출에 의한 고음영 부위가 확인되었다(Fig. 3E, F).
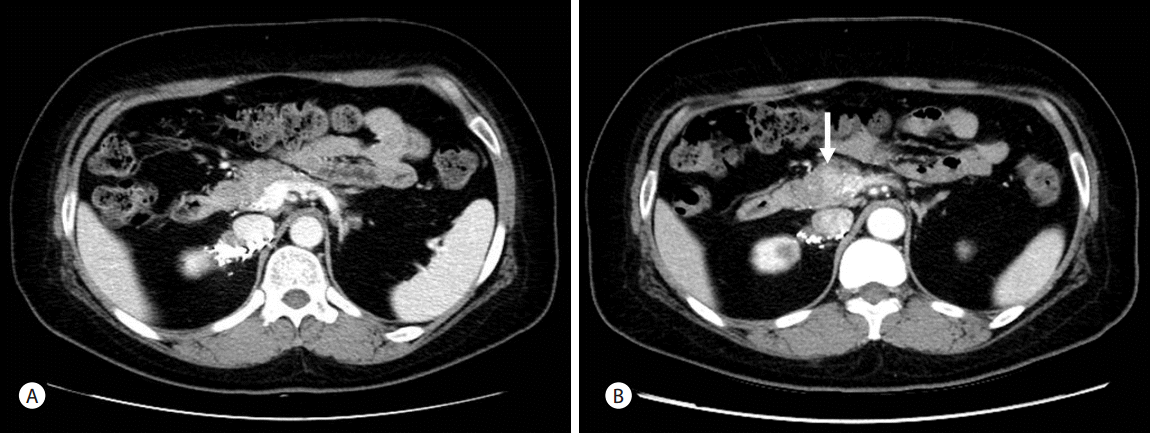
급성 췌장염으로 3주 동안 항균제 및 보존적 치료를 시행하였고, 이후 남은 병변에 대해 추가로 내시경 치료를 시행하였다. 상절치에서 50 cm에서 췌장 경부를 관찰하였을 때 1.6 × 1.5 × 1.1 cm 병변이 확인되어 에탄올과 리피돌 1:1 혼합용액을 4 mL 주입하였으나, 주입 중에 췌관으로 누출이 확인되었다. 투시검사로 확인하였을 때 병변 전체에 치밀하게 섭취되지 않아서 추가로 2.7 mL 주입하였다(Fig. 4). 두 번째 시술 후에도 발열 및 복통과 함께 아밀라제 733 U/L, 리파제 1106 U/L로 급성 췌장염이 발생하였으나, 1주일 만에 호전되어 퇴원하였다.
시술 후 영상검사에서 내시경 시술한 병변은 큰 변화 없이 유지되고 있었고, 시술을 하지 않은 췌장 미부의 병변 역시 크기 변화는 없었다. 췌장절제는 환자가 동의하지 않아 정기적으로 영상검사를 시행하기로 하였다. 치료 후 6개월 및 1년 후 시행한 검사에서는 이상 소견이 없었으나, 2년째에 시행한 영상검사에서, 이전 췌관과 교통이 있었던 시술 병변 주위로 종양의 침윤이 확인되었다(Fig. 5). 하지만 원격 전이는 없었고 및 췌장 미부의 종양의 크기도 변화가 없었으며, 수술에 적극적이지 않아 경과 관찰 중에 있다.
고 찰
다발내분비샘종양은 염색체의 이상으로 인해, 2개 이상의 내분비 조직에서 선종이나 과증식증을 유발한다[1]. 제1형은 뇌하수체, 부갑상선 그리고 췌장 중 2곳 이상에서 발생하는 경우로, 상염색체 우성으로 유전되며 가족성 또는 산발성으로 발생한다[1]. MEN1 환자에서 가장 흔한 증상은 부갑상샘 항진증에 의한 고칼슘혈증이며, 이는 MEN1 환자의 90%에서 확인된다[1,3]. 췌장의 NET는 30-80% 정도 동반되며, 가장 흔한 것은 가스트린종이며, 비기능성 종양은 이 중 30-81%를 차지한다[1]. 뇌하수체 종양은 40%에서 동반할 수 있다[1,3]. 이와 함께 부신피질종양, 갈색세포종, 지방종 등이 동반될 수 있다[1,3].
MEN1의 뇌하수체 종양의 치료는 산발성 뇌하수체 종양의 치료와 다르지 않아, 쿠싱병의 경우 TSA 종양절제를 시행한다[2,3]. 부갑상샘 기능항진증은 고칼슐혈증에 의한 다뇨, 변비, 소화성 궤양, 신장결석 등의 증상이 발생할 수 있으며, 이러한 경우에 부갑상선 전절제 또는 부분절제술을 시행할 수 있다[2,3]. 부신종양은 기능성 종양이거나, 악성 또는 4 cm 이상으로 크기가 큰 경우 절제를 고려한다[2,3].
MEN1 관련 사망원인의 58-64%는 악성 췌장종양으로 알려져 있어, 예후에 중요한 영향을 미친다[2,3,8]. 췌장종양의 치료 목표는 최대한 정상조직을 보호하면서, 호르몬에 의한 증상을 호전시키고, 전이를 막는 것이다[2,3]. 비기능성 췌장종양에 있어서 수술을 시행하는 것은 논란이 있으나, 1 cm 이상 또는 6-12개월 동안 크기의 변화가 있는 경우에는 절제하는 것을 권유하고 있다[2,3]. 하지만 수술을 거부하거나 불량한 전신상태로 인해 수술이 불가능한 경우에는 초음파내시경 시술을 고려할 수 있다[4-7]. Jürgensen 등[4]이 73세 여자 환자의 13 mm의 췌장 NET를 EUS-EI로 성공적으로 치료한 증례를 2006년에 처음으로 보고하였다. 이후 Park 등[6]은 11 명의 췌장 NET를 EUS-EI로 치료 후 370일(182-730일) 동안 관찰하였을 때, 8명(61.5%)에서 완전 반응이 있었다는 예비연구 결과를 보고하였다. 이 연구에서 시술 후 3명에서 췌장염(27.2%)이 발생하였고, 그중 한 명은 이후에 췌관 협착이 발생하여 스텐트를 삽입하였다[6]. 치료 실패의 경우 병변 내부로 혼합용액의 불균등한 분포 및 병변 주위 조직으로 침범이 있을 경우 시술의 효과가 제한적일 수 있음을 고려하였다[6]. Paik 등[7]은 8명의 췌장종양을 대상으로 한 EUS-EI의 안정성과 효과에 대한 관찰연구에서 6명은 성공적으로 치료되었으나 2명은 지속적으로 종양이 존재하였고, 그중 72세 여자 환자에서 심한 췌장염이 발생하였다고 보고하였다. 췌장염이 발생한 경우는 시술 중에 에탄올 누출이 있었던 경우였다[7]. 지속적으로 종양이 존재한 33세의 여자 환자는 추가로 췌장절제를 시행하였고 조직검사에서 주변 조직 침윤이 확인되었다[7]. 72세의 여자 환자는 고령 및 합병증 발생 이력으로 추가 처치를 하지 않았다[7].
본 환자는 어머니가 MEN1을 진단받았지만, 가족에 대한 유전상담이 이뤄지지 않았기에 증상 발생 후에 진단받았다. 먼저 증상을 동반한 쿠싱병에 대해 TSA 종양절제를 시행하였고, 이후 고칼슘혈증을 초래하고 있는 부갑상선에 대해 수술적 부분절제를 시행하였다. 마지막으로 비기능성 췌장 NET에 대해서는, 췌장 기능을 유지하기 위해 두부의 종양에 대해 EUS-EI를 시행하였다.
환자는 EUS-EI 후 합병증으로 심한 췌장염을 경험하였다. 시술 중에 췌관과 연결 및 시술용액의 누출이 의심되었다. 이후 촬영한 전산화단층촬영에서 주췌관 및 미부의 췌장에서 고음영 병변이 관찰되어 시술 용액의 누출이 확인되어 이로 인한 췌장염으로 판단하였다. 그리고 시술 2년 후, 첫 번째 시술시 췌관과 연결이 의심되었던 부위의 종양에서, 그 주변 부위 질병의 진행이 확인되었다. 환자의 경우 시술 용액의 병변 주위로의 누출과 함께, 췌관과의 연결로 인해, 종양 내부에 적절한 치료 용액의 농도를 유지하지 못한 것이 치료 실패 원인으로 추정된다. 또한 시술 이전에 주위 조직 침윤이 있었을 가능성 역시 배제할 수 없을 것으로 생각한다. 따라서 MEN1 환자의 췌장 NET의 경우 수술이 가능한 경우 수술을 원칙으로 해야 할 것으로 생각하며, 불가능한 경우 합병증과 재발 및 불완전 치료 가능성을 충분히 고려하여 EUS-EI를 시행해야 할 것으로 생각한다.