요약ERCP는 균혈증을 잘 일으키는 시술이며 시술 후 감염 발생빈도는 약 1.5% 정도로 낮으나 그 중 상당수는 중증이며 사망률 또한 높다. 최근의 ERCP 후 감염 발생률이 치료 목적의 시술 증가로 감소하지 않아 시술 전 폐쇄성 담관질환 등과 같은 ERCP 후 감염 고위험군을 미리 파악하여 감염을 예방하는 것이 효과적이다. 과거에는 불충분한 내시경 소독 또는 오염된 시술도구로 인해 ERCP 후 감염이 발생하였으나 최근 들어서는 십이지장경 엘리베이터 채널의 특수 구조에서 기인된 소독 취약성으로 인해 제조사의 소독 지침을 철저히 따르더라도 CRE 집단 감염 사태가 발생하였다. 따라서 이를 예방하기 위해서는 대한췌담도학회에서 공지한 ‘십이지장경을 통한 다제내성 균주 감염 전파를 예방하기 위한 권고 사항’을 준수해야 하고 보다 완벽한 소독방법과 내시경 구조개선에 대해 제조사 측과 논의가 필요하다. 간내 담관 또는 간문부 협착 환자의 경우 진단 목적으로는 MRCP를 시행하길 권하며 ERCP는 철저히 치료 목적으로 시행해야 한다. ERCP시 먼저 유도철사를 이용해 선택된 담관에 한해 조영제를 최소한으로 주입해야 하며 주입된 조영제는 가능한 완전히 배액하여 담관염 발생을 예방해야 한다. 담관내 조영제 주입 전 충분한 담즙 배액이나 조영제 대신 공기 또는 이산화탄소를 이용한 담관 조영이 시술 후 담관염 예방에 도움이 된다. ERCP 시술 전 예방적 항생제 사용이 시술 후 감염을 막는지 여부를 알기 위한 많은 연구들이 최근까지 발표되었지만 대상 환자와 방법의 다양성으로 인해 명확한 결론이 나지 않았으나 다음과 같은 경우 권유할 수 있다. 감염성 심내막염 발생시 심각한 결과를 초래할 수 있는 최고위험 심장 상태에서 담관염으로 ERCP를 시행할 경우, 간문부 담관암 또는 원발성 경화성 담관염과 같이 ERCP 후 불완전한 담관 배액이 예상되는 경우, 췌장 가성낭종 또는 괴사된 췌장조직 내로 조영제가 우발적으로 들어가서 감염이 예상될 경우, 금속관을 이용한 담관 배액시, 간이식 등 면역저하 환자에서는 시술이 끝난 후 충분한 배액이 이루어질 때까지 계속해서 예방적 항생제를 투여해야 한다. E.coli, Klebsiella, Enterobacter, Proteus, Citrobacter, Pseudomonas, Enterococci 에 대항하는 항생제 를 선택하며, cefotaxime, ciprofloxacin, ureidopenicillins, imipenem이 일반적으로 추천되며 상기 항생제 투여 후에도 계속해서 감염이 호전되지 않으면 Enterococci 를 방어하기 위해 amoxicillin 또는 vancomycin을 추가하거나 piperacillin/tazobactam으로 변경한다. 최근 제한적 항생제 사용을 하면서 광범위한 예방적 항생제를 사용하던 과거에 비해 ERCP 후 감염 또는 균혈증 발생이 감소하여 ‘제한적 항생제 정책’으로 나아가는 것이 타당성 있고 비용 효과적이며 항생제 내성 문제도 줄일 수 있겠다.ERCP 후 담관염 또는 담낭염이 발생하면 항생제 투여 및 수액요법과 함께 불충분한 담즙 배액이 의심되는 경우 ERCP를 재시행하여 적절한 담즙 배액술을 시행해야 하며, ERCP로 배액이 어렵거나 항생제 치료에도 증상 또는 간기능 이상이 개선되지 않으면 PTBD 또는 PTGBD를 즉시 고려해야 한다.
AbstractInfection is a known complication of endoscopic retrograde cholangiopancreatography (ERCP), occurring in up to 1.5% of cases. However, it is important to realize that true incidence may be underestimated because infection may go unnoticed. Post-ERCP infections are considered to be endogenous infections arising from the intestinal bacteria of the patient and introduction of exogenous bacteria through inadequately reprocessed duodenoscopes. During the past years, carbapenem resistance has become a major concern for public health. The infection outbreaks after ERCP are linked to breaches in adherence to disinfection manual and complex design of duodenoscopes difficult to reprocess. The most important risk factor for ERCP-related cholangitis is inadequate biliary drainage. To minimize the risk of post-ERCP infection it would be helpful that the volume of contrast injected into the biliary tree has to be minimized to obtain adequate cholangiogram. In patients with bile duct obstruction and failed drainage of infected bile via ERCP, every effort should be made to achieve prompt decompression of an obstructed biliary system. Antibiotic prophylaxis is recommended only in patients with biliary obstruction in which there is a possibility that complete drainage may not be achieved at the ERCP.
서 론2015년 미국 캘리포니아대학교 로스앤젤레스캠퍼스(University of California Los Angeles, UCLA) 로널드레이건 의료센터에서 내시경역행담췌관조영술(endoscopic retrograde cholangiopancreatography, ERCP)을 시행받은 환자들 중 7명이 carbapenem 내성 장내세균(carbapenem-resistant enterobacteriaceae, CRE)에 감염되었고 이 중 2명의 환자가 사망하는 사건이 있었는데 그 원인은 오염된 십이지장경을 통한 시술이 감염 원인이었다. 이렇듯 감염은 ERCP 후 발생할 수 있는 합병증들 중 하나로 담관염 또는 담낭염 형태로 나타나며 오염된 내시경 및 시술도구 또는 감염된 조영제 사용과 과도한 조영제 주입 후 배액 실패 등이 원인이다.
ERCP 후 감염의 발생빈도는 약 1.5% 정도로(췌장염 5.4%, 출혈 2.0%, 천공 0.3%, 심폐합병증 0.2%) 전체적인 발생빈도는 낮지만 감염 중 10-20%는 중증(10일 이상 입원 치료가 필요한 경우, 수술적 또는 침습 방사선학적 중재가 필요한 경우, 사망의 원인이 된 경우)이며 그 중 5-10% 정도는 사망에 이를 정도로 위험성은 상당하다[1-4].
시간 경과에 따른 감염 발생률은 과거 20년간의 1.1%보다 최근 10년간 1.7%로 의미 있게 증가하였으며 중증감염 발생 빈도 또한 감소하지 않았다. 최근 들어 ERCP 시술자들의 기술적 수준이 높아지고 환자 간호가 최적화되었지만 이 같이 감염 발생률이 오히려 증가하는 이유는 ERCP를 단순 진단보다 담즙 배액 등 치료 목적으로 적응증을 제한하고 좀 더 위중한 상태의 환자들에게 좀 더 복잡한 시술을 시행하기 때문으로 설명된다[3].
따라서 ERCP 후 감염 발생에 보다 적극적인 대처가 필요하며, 환자 및 보호자에게 ERCP 후 감염이 불가피하게 발생할 수 있고, 중증감염으로 진행할 수 있음을 설명해야 한다. 아울러 감염경로를 이해하고 고위험군을 미리 파악함으로써 감염 예방에 힘쓰는 것이 감염 발생 후 치료보다 더욱 효과적인 방법이라 생각된다. 이번 종설에서 ERCP 후 감염에 대한 예방적 관점에서 지금까지 보고된 논문들을 정리하고 효과가 입증된 사안들에 대해 논의하고자 한다.
감염 발생 기전 및 고위험군최근 발표된 소화기내시경시 예방적 항생제 사용에 대한 미국 소화기내시경학회 가이드라인에서 ERCP를 식도부지 확장술, 식도정맥류경화술 등과 함께 균혈증을 가장 잘 일으키는 내시경시술로 규정하고 있다[5].
건강한 사람의 담관내 담즙은 무균 상태이지만, 담관내 질병이 발생하거나 ERCP를 시행한 경우에는 장내세균이 장벽을 뚫고 혈행성으로 간문맥을 통하거나 역행성 경로로 바터씨 팽대를 통해 담관으로 이동한다[6,7]. 담즙내 주로 정착하는 세균들로는 장내세균인 Escherichia coli (E.coli), Klebsiella, Enterococcus, Enterobacter 순으로 많고, 오염된 내시경 또는 시술도구에 의한 의인감염인 경우 Pseudomonas가 많으며, 혐기성 균으로는 Bacteroides가 있다[8].
ERCP 후 발생하는 균혈증 발생률에 대한 연구에서 비폐쇄성 담관질환에서는 6.4%인 반면, 담석 또는 협착과 같은 폐쇄성 담관질환에서는 18%로 높다고 보고하였다[9]. 폐쇄성 담관질환 환자에서 균혈증 발생률이 높은 이유는 치료 목적의 ERCP를 시행할 때 담관내 정착한 세균이 조영제 주입에 의한 담관내 압력 상승이 발생하고 특히 불완전 배액시 혈액이나 조직 내로 세균의 침투가 용이하여 균혈증을 쉽게 유발할 수 있기 때문이며, 이로 인해 패혈증 특히 고위험군 심장질환에서는 심내막염으로까지 진행될 수 있다.
담관 폐쇄시 항생제의 담즙내 배설은 현격히 줄어들고, 담즙내 세균에 대한 항생제의 최소억제농도가 혈액과 비교시 천 배 이상 높기 때문에 예방적 항생제 사용은 담즙내 균 정착을 예방하기보다는 시술 후 균혈증을 막기 위함이 목적이다. 따라서 오염된 내시경 및 시술도구 등을 통한 담관내 세균 이동은 내시경 소독과 멸균된 또는 일회용 기구 사용으로 예방해야 하고, 다량의 조영제 투여 전 담관내 담즙을 충분히 흡입하고 담석을 완전히 제거하지 못한 경우 배액관을 삽입하여 담관내 압력 상승을 막아야 하며, 특히 간문부 담관암이나 간 이식 등 면역저하 환자들에서는 시술시 더욱 주의를 기울여야 ERCP 후 감염을 막을 수 있다[10,11].
ERCP 후 균혈증 발생 위험인자는 경피적-내시경적 동시 시술(랑데부 기술), 암성 담도 협착에서 스텐트 삽입, 원발경화담관염, 적은 ERCP 시술 경험, 불완전한 담즙 배액 등이다[1]. ERCP 후 균혈증을 일으키는 위험인자들에 대한 국내 연구에서는 간이식 과거력, 혈중 알칼리성 인산가수분해효소(alkaline phosphatase, ALP) 증가, 내시경역행담관배액술(endoscopic retrograde biliary drainage, ERBD)이 독립된 인자로 밝혀졌다. 간이식 환자는 면역이 약해 감염에 취약하며 주로 Pseudomonas 균혈증이 많았다. ALP 상승은 담즙 정체를 시사하는데 이는 결국 담관 폐쇄와 연관되고 ERBD도 비슷한 상황이다. 이 연구에서 보고된 배양균은 Escherichia가 가장 흔하였고, Klebsiella, Pseudomonas, Stephomonas, Enterococcus, Enterobacter 빈도 순이었다. 그리고 extended spectrum β-lactamases (ESBL)를 생성하는 균도 16%를 차지하는 것으로 보고하여 통상적 항생제에 반응이 충분치 않을 때에는 carbapenem 계열의 항생제로 변경이 필요하다[12].
감염 원인 및 예방1. 소독미국 솔트레이크에서 발생한 감염 사례들은 당일 첫 번째로 ERCP를 시술받은 환자들에서만 발생하였는데, 전날 마지막 내시경 소독 후 내시경에 소량의 균이 남아있는 상태에서 다음 날 첫 번째로 사용시 내시경의 불충분한 소독 후 다음 사용시까지 시간 간격이 길어 감염을 일으키기 충분할 정도로 균 증식이 이루어졌기 때문으로 설명하고 있다[15].
벨기에 사례에서는 새 내시경 자동세척기를 사용한 후 ERCP 후 균혈증 발생빈도가 1.6%에서 3.6%로 오히려 증가하였는데, 자동세척기를 이용해도 내시경 소독이 불충분하여 균혈증이 발생한 것으로 추정되며 세척기로 소독이 잘 안 되는 내시경 채널에 대해 추가 세척 및 소독을 시행함으로써 균혈증 발생빈도를 1.7%까지 다시 감소시킬 수 있었다고 보고하였다[16].
ERCP 후 ESBL 생성 Klebsiella pneumoniae 감염 발생을 보고한 프랑스 연구에서는 십이지장경, 세척기, 내시경실에서 시행한 통상적인 배양검사로는 원인 균 검출에 실패하였고, 내시경 채널에 대한 세척 및 솔질 후에 원인균이 검출되어 불충분한 손세척과 건조 과정이 감염의 원인이며, 적극적인 배양검사가 십이지장경의 오염을 규명하는데 중요하다고 주장하였다[17].
최근 ERCP 후 CRE 감염이 많아짐을 보고한 연구에서는 과거에도 CRE 감염이 많았지만 대부분 간과되어 지금까지 보고된 사례들은 빙산의 일각에 불과하며 앞으로 내시경을 통한 CRE 감염을 막으려면 감염 관리 가이드라인을 철저히 따라야 한다고 제안하였다[18].
미국 일리노이즈에서는 ERCP 후 New Delhi metallo-β-lactamase 생성 CRE 감염이 십이지장경 소독과정에 실수가 없었는데도 발생하였고, 내시경 엘리베이터의 복잡한 구조로 인해 ortho-phthalaldehyde 소독제를 이용한 높은 수준의 자동소독으로도 제대로 소독이 안되고 지속적으로 균이 검출되었는데, ethylene oxide를 이용한 가스 소독으로 바꾼 후에야 더 이상 균이 검출되지 않아 내시경 소독 과정에 대한 전반적인 검토를 실시해야 한다고 제안하였다[19].
미국 UCLA 로널드레이건 의료센터와 네덜란드 에라스무스 대학병원에서 발생한 CRE 감염의 원인은 십이지장경 새 모델의 특징인 내시경 선단부의 고정된 캡과 밀봉된 엘리베이터 와이어 채널 연결부 등의 특수한 구조로 인해 오히려 엘리베이터 및 엘리베이터 채널 부분의 소독이 어려워져 일어난 것으로, 사후 미국에서는 내시경 제조사 측의 자발적 리콜과 함께 더욱 철저한 밀봉 시스템으로의 무상수리로 사태를 해결하였다. 에라스무스병원의 경우에도 새로운 십이지장경 사용을 중지하고서야 CRE 감염 발생을 종결할 수 있었으며 새로운 내시경 디자인이 소독에 미치는 영향에 대해서 판매 전 충분한 검증과 판매 후 엄중한 감시가 법으로 정해져야 한다고 주장하였다[20]. 국내에 보급된 십이지장경은 내시경 선단의 캡을 분리할 수 있게 되어 있어 엘리베이터 채널 부위의 세척이 용이하다.
로널드레이건 의료센터 사건 발생 직후 대한췌담도학회 정책-질관리 위원회는 이 같은 상황이 국내에서 발생하지 않도록 다음과 같은 ‘십이지장경을 통한 다제내성 균주 감염 전파를 예방하기 위한 권고’ 7가지 사항을 학회 홈페이지에 공지하는 동시에 뉴스레터로 발송하였다: (1) 각 병원은 감염위원회를 열어서 해당 기관의 CRE 혹은 vancomycin-resistant enterococcus (VRE) 감염 사례를 조사하고, 감염자에게 내시경 시술이 필요한 경우에는 사전에 내시경실로 통보하도록 한다. (2) 내시경실에서는 사용 중인 십이지장경 전수를 엘리베이터 선단을 포함하여 배양검사를 시행한다. 이후는 각 병원의 지침에 따라 주기적인 배양검사를 시행한다. (3) 내시경실에서는 십이지장경을 정해진 가이드라인에 따라 세척소독하며 특히 엘리베이터와 채널을 상하방향으로 움직이면서 솔을 이용하여 철저히 세척한다. (4) CRE나 VRE 감염 환자는 ERCP 외 다른 방법의 치료를 선택하도록 유도한다. (5) CRE 혹은 VRE 균 보유 환자가 ERCP가 반드시 필요한 경우 혹은 십이지장경이 이러한 균에 오염된 경우 십이지장경의 세척 및 소독에 대한 대책을 논의한다. (6) 내시경시술 의사나 내시경실 근무 종사자들에게 내시경을 통한 CRE 감염의 위험성과 그 대책에 대하여 교육을 시행한다. (7) 엘리베이터가 있는 내시경을 이용한 시술 후에는 사용한 내시경을 나중에 확인할 수 있도록 일련번호를 결과지에 기록한다. 학회에서는 이와 함께 십이지장경의 다제내성균 오염에 대비한 완전한 소독 방법과 십이지장경의 구조 개선을 위해 제조사 측과 심도 있는 논의가 필요하다고 밝혔다.
2. 술기간내 또는 간문부 담관 협착 환자에서 ERCP 시행시 협착 상부 담관에 주입된 조영제가 배액이 안될 경우 담관염 발생 위험이 높아진다. 따라서 이런 환자에게는 가급적 진단 목적의 ERCP보다는 자기공명담췌관조영술(magnetic resonance cholangiopancreatography)을 시행하길 권하며 ERCP는 치료 목적으로만 시행하는 것이 바람직하다. 간문부 담관암에서 ERCP로 부득이 간내 담관을 조영할 시에는 먼저 유도철사를 이용한 선택적 삽관 후 삽관된 담관에 한하여 조영제를 최소한으로 주입하고, 조영제가 주입된 담관은 가능한 배액해야 하며, 간내 담관에 광범위하게 조영제를 과다 주입하는 것은 피해야 한다. 시술 후 담관 배액이 불충분한 경우에는 ERBD 또는 내시경적 비담관배액술(endoscopic nasobiliary drainage, ENBD)을 시행해야 하고, 이러한 내시경 배액술마저 실패한 경우에는 즉시 경피경간 담도배액술(percutaneous transhepatic biliary drainage, PTBD)을 시행해야 한다[21]. 반면에, 총담관 담석에 의한 담관염 환자에서는 담석을 완전히 제거한 후 예방 목적으로 ENBD를 삽입하는 것은 일반적으로 추천되지 않는다[22].
담관염 환자에서 ERCP시 과도한 조영제 주입은 담관내 압력을 더욱 상승시켜 담관내 감염된 세균이 혈액으로 이동할 위험을 증가시킬 수 있으므로 먼저 감염된 담즙을 배액하여 담관내 압력을 떨어뜨린 후 계획된 치료내시경 시술을 시행하는 것이 안전하다[21]. 한편 국내 연구에서 조영제 주입 직전 일정량의 담즙을 흡인하는 담관 감압이 담관염의 발생빈도를 감소시키는데 미흡하다고 보고하였는데, 이는 연구 방법에서 대상군과 대조군 모두에게 시술 전 항생제를 투여함으로써 담관 감압이 담관염 예방에 미치는 영향을 약화시켜 이 같은 결과를 초래했을 가능성도 있다[23].
3. 예방적 항생제 사용1) ERCP시 예방적 항생제 연구들ERCP시 예방적 항생제 사용이 시술 후 감염 예방에 유용한지 여부를 알기 위해 지금까지 많은 연구들이 시행되었으나 연구 방법, 대상 환자군, 사용한 항생제 종류 및 투여 시점들이 모두 제각기 달라 상충되는 결과들을 보여주고 있다. 본 종설에서는 최근 발표된 무작위 연구 메타분석과 예방적 항생제 사용에 대한 미국 소화기내시경학회 가이드라인을 중심으로 예방적 항생제 사용에 대해 정리해 보았다.
ERCP 후 합병증인 감염에 대한 다양한 연구 보고들이 연구 설계부터 상이하고, 감염 발생률 자체가 상당히 낮은 특성상 통계학적 파워를 갖기 위해서는 대규모 연구가 필요한 점들 때문에 연구 결과들이 상충되어 예방적 항생제 유용성에 대해서 결론을 낼 수 없었다. 이러한 제한점을 극복하기 위해 지금까지 발표된 다수의 무작위 연구들을 모아 메타분석한 논문들이 발표되었다.
5개의 무작위 연구들에 대한 메타분석에서 ERCP 전 통상적 예방적 항생제 투여는 담관염과 패혈증 발생빈도를 낮추는데 실패하였다고 보고하였다[27]. 총 1,389명의 환자들을 대상으로 한 7개 무작위 연구 메타분석도 앞선 논문과 비슷한 결과를 보였다[28]. 반면, 총 1,573명의 환자들을 대상으로 한 9개 연구들의 코크런리뷰 분석에서는 비응급 ERCP시 예방적 항생제 투여가 균혈증 빈도를 낮추고 담관염과 패혈증을 방지할 수 있다고 상반된 결과를 보고하였다(Table 1)[29].
앞서 언급한 2개의 메타분석들과 이번 코크런분석 결과가 서로 다른 이유는 분석에 포함된 연구 대상들에서 시행된 ERCP의 이질성 때문으로 생각된다. 코크런분석 중 특이한 점은 ERCP 후 담관 폐쇄가 완전히 소실된 환자군만을 따로 분석하였을 때 예방적 항생제가 도움이 되지 않아 저자들은 첫 ERCP에서 담관 폐쇄가 완전히 해결되지 않은 환자들에서만 예방적 항생제가 도움이 될 것이란 결론을 내렸다(Table 2). 또한 이를 증명하기 위해서는 첫 ERCP로 담관 폐쇄가 해결되지 않을 것으로 예측되는 환자들만을 대상으로 추가 연구가 필요하며 항생제 투여 시점도 시술 중 또는 시술 후 등으로 달리해야 함을 제언하였다[29].
예방적 항생제를 조영제와 혼합하여 투여한 시도도 있었는데, 생체 외 실험에서 조영제에 gentamicin을 혼합한 후Pseudomonas균 배지에 투여하였을 때 감수성 균인 경우 균이 모두 사멸되었으며 내성균인 경우 균 수를 감소시키는 효과를 보였다[30]. 그러나 비담석성 담관 폐쇄 환자에서 담관염 예방을 목적으로 똑같은 실험을 진행한 결과 조영제에 gentamicin을 추가해도 ERCP 후 담관염 발생에 영향을 미치지 못하였다. 하지만 이 실험에서 대상군과 비교군 모두에 예방적 항생제를 미리 정맥 투여하였고 모든 예에서 스텐트를 삽관하여 배액시켰으며 ERCP 후 담관염 발생 환자 수가 너무 적었다는 제한점들이 있었다[31].
2) 예방적 항생제가 도움이 되는 임상 상황(1) 감염성 심내막염 예방2007년 미국 심장협회의 감염성 심내막염 예방에 대한 가이드라인에서 ERCP를 포함한 소화기내시경 시술시 오로지 감염성 심내막염 예방을 위해서는 더 이상 예방적 항생제 사용을 권하지 않았다. 다만 감염성 심내막염 발생시 심각한 결과를 초래할 수 있는 다음과 같은 최고위험의 심장질환에서 담관염이 발생하여 ERCP를 시행할 예정인 경우에는 예방적 항생제 사용을 권하였다: 1) 인공심장판막 2) 감염성 심내막염 과거력 3) 심장판막증을 가진 심장이식 환자 4) 고식적 단락과 도관을 가진 치료받지 않은 청색증 선천성 심장질환 5) 최근 6개월 이내에 삽입된 인공장치를 가진 치료받은 선천성 심장질환 6) 인공패취에 잔여결손을 가진 치료받은 선천성 심장질환. 담즙에서 분리되는 균주들 중 상기 질환 환자들에서 심내막염을 초래하는 것은 Enterococci이므로 이 균에 의한 감염을 예방하기 위해 penicillin, ampicillin, piperacillin, vancomycin 등을 예방적 항생제로 투여한다. 그러나 이러한 치료가 감염성 심내막염을 예방하였음을 증명한 연구들은 아직까지 없었다라고 가이드라인은 강조하였다[32]. 상기 내용은 2015년 미국 소화기내시경학회의 위장관 내시경시 예방적 항생제 사용에 대한 가이드라인에서도 그대로 인용되었다[5].
(2) 불완전 배액예방적 항생제는 간문부 담관암 또는 원발성 경화성 담관염과 같이 ERCP 후 불완전한 담관배액이 발생하는 상황에서 도움이 된다. 예방적 목적으로 투여한 항생제는 시술이 끝난 후에도 충분한 담관배액이 이루어질 때까지 계속해서 투여해야 한다[33].
주췌관과 연결된 췌장내 유두상 점액종양 등의 췌장 낭종성병변 환자에서 예방적 항생제 역할에 대한 연구는 아직까지 없으나 통상의 ERCP시 감염률이 낮아 예방적 항생제를 권유하지 않는다. 그러나 췌장 가성낭종 또는 괴사된 췌장조직 내로 조영제가 우발적으로 들어가서 감염이 예상될 경우 시술 직후 항생제 투여를 시작해서 배액이 충분히 되거나 괴사가 호전될 때까지 계속해서 항생제를 투여함으로써 감염 빈도를 낮출 수 있다[5].
(3) 면역저하심한 백혈구감소증(백혈구 절대수가 500/µL 미만)인 경우 또는 진행성 혈액암인 경우 내시경 시술 후 패혈증 위험성이 높아 이러한 경우 예방적 항생제가 도움이 될 것으로 생각되나 아직 증명된 임상 연구는 없다[38].
3) 예방적 항생제 종류 및 투여 기간항생제 선택시 항균범위, 내성균 제거, 부작용 정도, 비용 등을 고려해야 한다. 앞서 언급한 담즙내 정착하는 균주들 중 α-hemolytic Streptococci는 오로지 심내막염과 관련되며 혐기성 균주는 심한 감염에서나 드물게 동정되어 일반적으로 예방할 필요는 없다. 따라서 E.coli, Klebsiella, Enterobacter, Proteus, Citrobacter, Pseudomonas, Enterococci에 대항하는 항생제를 선택하면 되지만, 지역 또는 병원별 항생제 내성 정도 등도 감안했을 때 cefotaxime, ureidopenicillins, ciprofloxacin, imipenem이 일반적으로 추천된다. 그 중 ciprofloxacin이 가격적 측면뿐 아니라 담관 내로 배출된다는 점에서 좀 더 추천된다. 만일 ciprofloxacin을 계속해서 투여해도 열이 발생하면 Enterococci를 방어하기 위해 amoxicillin 또는 vancomycin을 추가하거나 piperacillin/tazobactam으로 변경한다[10].
4) 예방적 항생제 사용 실태 및 투여 정책한 단일기관에서 6년간 327명의 환자를 대상으로 ERCP 후 감염 발생빈도를 연구한 결과 간문부암, 원발성 또는 이차성 경화성 담관염, 담즙배출이 불완전한 경우, 인공판막, 심내막염 과거력 등에만 제한적으로 예방적 항생제를 투여한 경우에도 담관염 발생률은 3.4%로 낮다라고 보고하였다. 이때 투여한 항생제는 유럽 가이드라인에 따라 amoxicillin/clavulanate, gentamicin 또는 ciprofloxacin이었다[41].
11년 동안 11,484명의 ERCP 시술 환자들을 대상으로 한 후향적 연구에서도 예방적 항생제에 대한 초기 광범위한 적응증과 후기 불완전 담관 배액이 예상되는 또는 면역저하 환자들만을 대상으로 한 제한적 적응증으로 나누어 비교 분석한 결과 감염률은 각각 0.28%와 0.23%로 차이가 없었으며, 다변량 분석에서 항생제를 사용함에도 불구하고 간이식 환자에서만 유의하게 감염 발생이 높았다(1.2%)고 보고하였다[11].
예방적 항생제의 유용성과 비용에 대한 연구에서는 담관 폐쇄 환자에서 예방적 항생제 투여가 담관염 합병증 발생을 낮추고 비용 효과면에서도 좋았다고 보고하였다[42].
최근 한 후향적 연구에서 ERCP 전 예방적 항생제 사용이 담관내 항생제 내성균 출현의 위험요인이 될 수 있다고 보고하였다. 담관염이 없는 환자들을 ERCP 시술 전 예방적 항생제 투여 유무에 따라 두 군으로 나누었을 때 추후 췌장 및 담도 수술시 시행한 담즙 배양에서 내성균 발생이 예방적 항생제 투여군에서 의미 있게 높았다고 보고하여, 수술 후 감염 발생시 적절한 항생제 선택이 어려울 수 있다. 특히 외부로 배액시키는 ENBD보다 내부로 배액시키는 ERBD인 경우 예방적 항생제 투여군에서 담관내 세균 수와 약제내성 균 비율이 의미 있게 높아 가급적이면 ERBD나 예방적 항생제 사용을 피할 것을 권고하였다[43].
상기 논문들의 결론은 과거 예방적 항생제의 무분별 사용시 ERCP 후 감염, 균혈증 발생빈도에 비해 최근 제한적으로 사용시 오히려 감염 발생빈도가 더 낮은 현상을 들어 예방적 항생제의 제한적 사용에 대해 정당화하는 분위기이다. 최근 발표된 국외 예방적 항생제 사용 가이드라인들도 ‘제한적 항생제 정책’으로 진행되고 있는데, 이러한 정책은 타당성 있고, 비용 효과적이며, 항생제 내성 문제도 줄일 수 있어 앞으로 국내 병원에서도 지향해야 할 것으로 생각한다.
진단 및 치료ERCP 후 담관염은 시술 전 발열이 없던 환자가 시술 후 24시간 이상 38℃ 이상 열이 발생한 경우, 균혈증 또는 전신 염증성 반응을 동반한 패혈증, 비정상 간기능 또는 기존에 담관염이 이미 존재했던 경우에는 시술 이전보다 1가지 이상 간기능 수치가 50% 이상 증가한 경우, 우상복부 통증이 있으면서 담도계 이외의 원인을 배제할 수 있는 경우, 황달, 혈중 백혈구 증가, 영상 검사에서 담관 확장이 악화된 경우 진단할 수 있다[41,44]. 치료로는 항생제 투여 및 수액요법과 함께 적절한 담즙 배액술이 필요하다. 총담관 담석이 남아 있거나 유두부 부종에 의한 담즙 정체, 삽입한 배액관의 기능 이상 등이 의심되면 ERCP를 바로 다시 하여 적절한 담즙 배액술을 시행해야 하며, 간문부 협착 환자인 경우에 ERCP로 배액이 어렵고 항생제 치료에도 반응이 없다면 PTBD 시행을 고려해야 한다.
ERCP 후 담낭염은 시술 전 담낭염이 없던 환자가 시술 후 우상복부 통증 및 발열이 있으면서 특징적인 머피 징후(Murphy’s sign), 영상 검사에서 담낭 확장, 담낭벽 비후, 담낭 주변으로 염증 확장 등의 소견이 관찰될 경우 진단할 수 있다. 항생제 치료로 반응이 없는 경우 경피경간 담낭배액술(percutaneous transhepatic gallbladder drainage, PTGBD) 또는 담낭절제술을 고려해야 한다(Fig. 1).
결 론ERCP 후 감염 발생빈도는 낮으나 그 중 상당수는 중증이며 사망률 또한 높다. 치료 목적의 ERCP가 증가하면서 감염 발생률 또한 낮아지지 않고 있어 고위험군을 미리 파악하여 감염을 예방하는 것이 효과적이다.
십이지장경의 특수한 구조로 인한 불충분한 내시경 소독이 최근 다제내성 균주 집단 감염 발생의 원인이 되고 있어 예방을 위해서는 철저히 소독 지침을 따라야 하고 향후 내시경 구조 개선을 논의해야 한다.
ERCP는 치료 목적으로 시술해야 하고, 담관 협착 환자에서 주입된 조영제를 충분히 배액해야 시술 후 감염을 예방할 수 있다.
ERCP시 예방적 항생제는 시술 후 불완전 담관 배액이 예상되는 경우 권하고, 장내세균에 대항하는 항생제를 선택해야 하며, 항생제 내성을 줄이기 위해 가급적 제한적으로 사용해야 한다.
ERCP 후 감염이 발생하면 보존적 치료와 함께 적절한 담즙배액술을 시행해야 한다.
REFERENCES1. Freeman ML, Nelson DB, Sherman S, et al. Complications of endoscopic biliary sphincterotomy. N Engl J Med 1996;335:909-918.
2. Williams EJ, Taylor S, Fairclough P, et al. Risk factors for complication following ERCP; results of a large-scale, prospective multicenter study. Endoscopy 2007;39:793-801.
3. Andriulli A, Loperfido S, Napolitano G, et al. Incidence rates of post-ERCP complications: a systematic survey of prospective studies. Am J Gastroenterol 2007;102:1781-1788.
4. Colton JB, Curran CC. Quality indicators, including complications, of ERCP in a community setting: a prospective study. Gastrointest Endosc 2009;70:457-467.
5. ASGE Standards of Practice Committee, Khashab MA, Chithadi KV, et al. Antibiotic prophylaxis for GI endoscopy. Gastrointest Endosc 2015;81:81-89.
6. Sung JY, Shaffer EA, Olson ME, Leung JW, Lam K, Costerton JW. Bacterial invasion of the biliary system by way of the portal-venous system. Hepatology 1991;14:313-317.
7. Sand J, Airo I, Hiltunen KM, Mattila J, Nordback I. Changes in biliary bacteria after endoscopic cholangiography and sphincterotomy. Am Surg 1992;58:324-328.
8. Leung JW, Ling TK, Chan RC, et al. Antibiotics, biliary sepsis, and bile duct stones. Gastrointest Endosc 1994;40:716-721.
9. Nelson DB. Infectious disease complications of GI endoscopy: part I, endogenous infections. Gastrointest Endosc 2003;57:546-556.
10. Subhani JM, Kibbler C, Dooley JS. Review article: antibiotic prophylaxis for endoscopic retrograde cholangiopancreatography (ERCP). Aliment Pharmacol Ther 1999;13:103-116.
11. Cotton PB, Connor P, Rawls E, Romagnuolo J. Infection after ERCP and antibiotic prophylaxis: a sequential quality-improvement approach over 11 years. Gastrointest Endosc 2008;67:471-475.
12. Kwak MS, Jang ES, Ryu JK, Kim YT, Yoon YB, Park JK. Risk factors of post endoscopic retrograde cholangiopancreatography bacteremia. Gut Liver 2013;7:228-233.
13. Earnshaw JJ, Clark AW, Thom BT. Outbreak of Pseudomonas aeruginosa following endoscopic retrograde cholangiopancreatography. J Hosp Infect 1985;6:95-97.
14. Bass DH, Oliver S, Bornman PC. Pseudomonas septicaemia after endoscopic retrograde cholangiopancreatography--an unresolved problem. S Afr Med J 1990;77:509-511.
15. Classen DC, Jacobson JA, Burke JP, Jacobson JT, Evans RS. Serious Pseudomonas infections associated with endoscopic retrograde cholangiopancreatography. Am J Med 1988;84(3 pt 2):590-596.
16. Struelens MJ, Rost F, Deplano A, et al. Pseudomonas aeruginosa and Enterobacteriaceae bacteremia after biliary endoscopy: an outbreak investigation using DNA macrorestriction analysis. Am J Med 1993;95:489-498.
17. Aumeran C, Poincloux L, Souweine B, et al. Multidrug-resistant Klebsiella pneumoniae outbreak after endoscopic retrograde cholangiopancreatography. Endoscopy 2010;42:895-899.
18. Gastmeier P, Vonberg RP. Klebsiella spp. in endoscopy-associated infections: we may only be seeing the tip of the iceberg. Infection 2014;42:15-21.
19. Epstein L, Hunter JC, Arwady MA, et al. New Delhi metallo-β-lactamase-producing carbapenem-resistant Escherichia coli associated with exposure to duodenoscopes. JAMA 2014;312:1447-1455.
20. Verfaillie CJ, Bruno MJ, Voor in 't Holt AF, et al. Withdrawal of a novel-design duodenoscope ends outbreak of a VIM-2-producing Pseudomonas aeruginosa. Endoscopy 2015;47:493-502.
21. Mergener K. Complications of endoscopic and radiologic investigation of biliary tract disorders. Curr Gastroenterol Rep 2011;13:173-181.
22. Lee JK, Lee SH, Kang BK, et al. Is it necessary to insert a nasobiliary drainage tube routinely after endoscopic clearance of the common bile duct in patients with choledocholithiasis-induced cholangitis? A prospective, randomized trial. Gastrointest Endosc 2010;71:105-110.
23. Choi JS, Kang DH, Kim HD, et al. Clinical effects of bile aspiration just before contrast injection during endoscopic retrograde cholangiopancreatography. Korean J Gastroenterol 2012;60:368-372.
24. Pisello F, Geraci G, Modica G, Sciumè C. Cholangitis prevention in endoscopic Klatskin tumor palliation: air cholangiography technique. Langenbecks Arch Surg 2009;394:1109-1114.
25. Sud R, Puri R, Choudhary NS, Mehta A, Jain PK. Air cholangiogram is not inferior to dye cholangiogram for malignant hilar biliary obstruction: a randomized study of efficacy and safety. Indian J Gastroenterol 2014;33:537-542.
26. Zhang R, Zhao L, Liu Z, et al. Effect of CO2 cholangiography on post-ERCP cholangitis in patients with unresectable malignant hilar obstruction - a prospective, randomized controlled study. Scand J Gastroenterol 2013;48:758-763.
27. Harris A, Chan AC, Torres-Viera C, Hammett R, Carr-Locke D. Meta-analysis of antibiotic prophylaxis in endoscopic retrograde cholangiopancreatography (ERCP). Endoscopy 1999;31:718-724.
28. Bai Y, Gao F, Gao J, Zou DW, Li ZS. Prophylactic antibiotics cannot prevent endoscopic retrograde cholangiopancreatography-induced cholangitis: a meta-analysis. Pancreas 2009;38:126-130.
29. Brand M, Bizos D, O'Farrell P Jr. Antibiotic prophylaxis for patients undergoing elective endoscopic retrograde cholangiopancreatography. Cochrane Database Syst Rev 2010;(10):CD007345.
30. Ramirez FC, Osato MS, Graham DY, Woods KL. Addition of gentamicin to endoscopic retrograde cholangiopancreatography (ERCP) contrast medium towards reducing the frequency of septic complications of ERCP. J Dig Dis 2010;11:237-243.
31. Norouzi A, Khatibian M, Afroogh R, Chaharmahali M, Sotoudehmanesh R. The effect of adding gentamicin to contrast media for prevention of cholangitis after biliary stenting for non-calculous biliary obstruction, a randomized controlled trial. Indian J Gastroenterol 2013;32:18-21.
32. Wilson W, Taubert KA, Gewitz M, et al. Prevention of infective endocarditis: guidelines from the American Heart Association: a guideline from the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee, Council on Cardiovascular Disease in the Young, and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research Interdisciplinary Working Group. Circulation 2007;116:1736-1754.
33. Byl B, Devière J, Struelens MJ, et al. Antibiotic prophylaxis for infectious complications after therapeutic endoscopic retrograde cholangiopancreatography: a randomized, double-blind, placebo-controlled study. Clin Infect Dis 1995;20:1236-1240.
34. Saxena P, Singh VK, Lennon AM, Okolo PI, Kalloo AN, Khashab MA. Endoscopic management of acute cholecystitis after metal stent placement in patients with malignant biliary obstruction: a case series. Gastrointest Endosc 2013;78:175-178.
35. Isayama H, Kawabe T, Nakai Y, et al. Cholecystitis after metallic stent placement in patients with malignant distal biliary obstruction. Clin Gastroenterol Hepatol 2006;4:1148-1153.
36. Saleem A, Leggett CL, Murad MH, et al. Meta-analysis of randomized trials comparing the patency of covered and uncovered self-expandable metal stents for palliation of distal malignant bile duct obstruction. Gastrointest Endosc 2011;74:321-327.
37. Almadi MA, Barkun AN, Martel M, et al. No benefit of covered vs uncovered self-expandable metal stents in patients with malignant distal biliary obstruction: a meta-analysis. Clin Gastroenterol Hepatol 2013;11:27-37.el.
38. Bianco JA, Pepe MS, Higano C, Applebaum FR, McDonald GB, Singer JW. Prevalence of clinically relevant bacteremia after upper gastrointestinal endoscopy in bone marrow transplant recipients. Am J Med 1990;89:134-136.
39. Balderramo D, Bordas JM, Sendino O, et al. Complications after ERCP in liver transplant recipients. Gastrointest Endosc 2011;74:285-294.
40. Niederau C, Pohlmann U, Lübke H, Thomas L. Prophylactic antibiotic treatment in therapeutic or complicated diagnostic ERCP: results of a randomized controlled clinical study. Gastroint Endosc 1994;40:533-537.
41. Kager LM, Sjouke B, van den Brand M, Naber TH, Ponsioen CY. The role of antibiotic prophylaxis in endoscopic retrograde cholangiopancreatography; a retrospective single-center evaluation. Scand J Gastroenterol 2012;47:245-250.
42. Thompson BF, Arguedas MR, Wilcox CM. Antibiotic prophylaxis prior to endoscopic retrograde cholangiopancreatography in patients with obstructive jaundice: is it worth the cost? Aliment Pharmacol Ther 2002;16:727-734.
43. Minami T, Sasaki T, Serikawa M, Ishigaki T, Murakami Y, Chayama K. Antibiotic prophylaxis for endoscopic retrograde chlangiopancreatography increases the detection rate of drug-resistant bacteria in bile. J Hepatobiliary Pancreat Sci 2014;21:712-718.
44. Cotton PB, Lehman G, Vennes J, et al. Endoscopic sphincterotomy complications and their management: an attempt at consensus. Gastrointest Endosc 1991;37:383-393.
45. Brandes JW, Scheffer B, Lorenz-Meyer H, Körst HA, Littmann KP. ERCP: complications and prophylaxis a controlled study. Endoscopy 1981;13:27-30.
46. Sauter G, Grabein B, Huber G, Mannes GA, Ruckdeschel G, Sauerbruch T. Antibiotic prophylaxis of infectious complications with endoscopic retrograde cholangiopancreatography. A randomized controlled study. Endoscopy 1990;22:164-167.
47. Lorenz R, Lehn N, Born P, Herrmann M, Neuhaus H. Antibiotic prophylaxis using cefuroxime in bile duct endoscopy. Dtsch Med Wochenschr 1996;121:223-230.
48. Van den Hazel SJ, Speelman P, Dankert J, Huibregtse K, Tytgat GNJ, Van Leeuwen DJ. Piperacillin to prevent cholangitis after endoscopic retrograde cholangiopancreatography. A randomized, controlled trial. Ann Intern Med 1996;125:442-447.
49. Räty S, Sand J, Pulkkinen M, Matikainen M, Nordback I. Post-ERCP pancreatitis: reduction by routine antibiotics. J Gastrointest Surg 2001;5:339-345 discussion 345.
50. Spicak J, Stirand P, Zavoral M, Keil R, Zavada F, Drabek J. Antibiotic prophylaxis of cholangitis complicating endoscopic treatment of biliary obstruction. Ceska Slov Gastroenterol Hepatol 2001;55:211-215.
Fig. 1.Summary of prevention, diagnosis and treatment of post-endoscopic retrograde cholangiopancreatography infection. ERCP, endoscopic retrograde cholangiopancreatography. 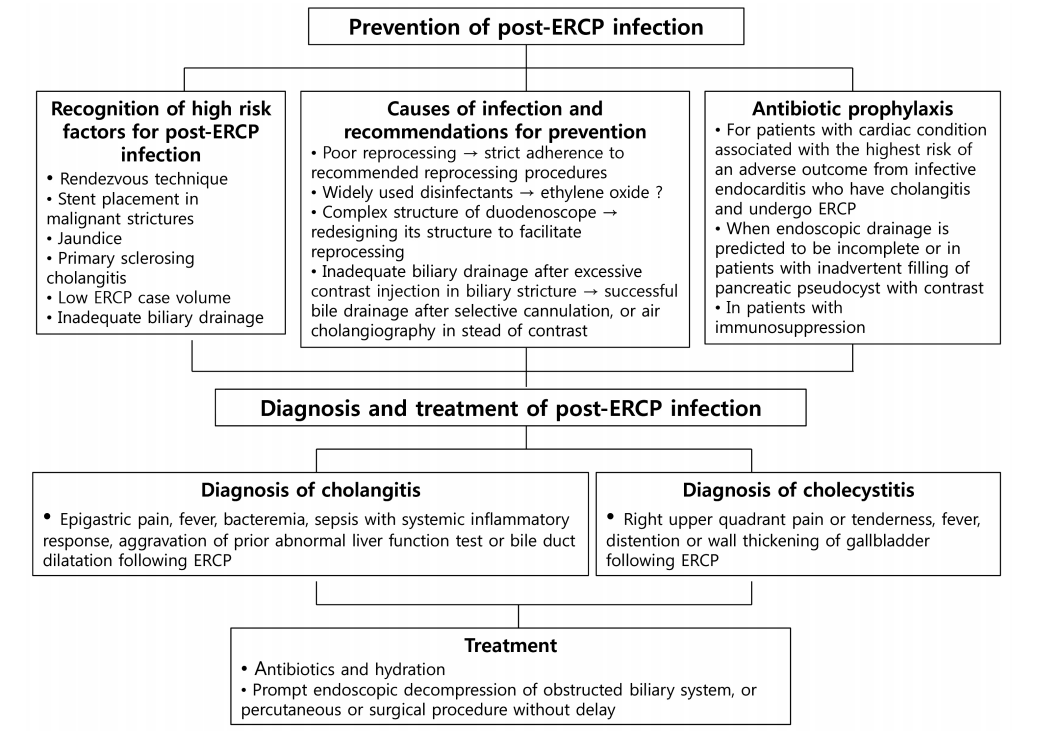
Table 1.Summary of studies on antibiotic prophylaxis for patients undergoing elective endoscopic retrograde cholangiopancreatography [29]
Table 2.Effects of prophylactic antibiotics vs placebo (all patients providing data for a certain outcome) [29]
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||