악성 담도 협착에서 자가팽창형 금속 스텐트의 폐쇄를 예측하는 산도 센서 및 폐쇄를 지연하는 항균 스텐트의 임상적 적용 가능성 탐색
Exploring the Clinical Applicability of pH Sensors Predicting Obstruction in Self-Expandable Metal Stents for Malignant Biliary Stenosis, and Antimicrobial Stents Delaying the Obstruction
Article information
본고에서는 악성 담도 협착으로 자가팽창형 금속 스텐트(self-expandable metal stent, SEMS)를 사용한 환자군에서 pH 측정 센서를 활용하여 담도 폐쇄를 미리 예측하는 스텐트 개발에 대해 논의해 보고자 한다.
담도암 및 췌장암과 같은 악성 종양이 담도를 침범하는 경우, 담도 폐쇄로 인한 황달 및 담도염이 발생할 수 있고, 이러한 합병증은 암환자의 예후를 악화시킬 수 있다. 일반적으로 악성 담도 폐쇄가 발생하게 되면 이를 치료하기 위해 스텐트를 담관에 삽입하여 담도배액술을 시행하게 된다. 이때 사용하는 스텐트의 재질은 유지기간과 치료 성공률에 큰 영향을 미치므로 환자의 건강상태와 치료비용을 고려하여 결정해야 하며, 플라스틱 스텐트에 비해 금속 스텐트의 경우 유지기간이 더 길다는 장점을 가진다. 하지만 금속 스텐트의 경우에도 이동 및 폐색 등으로 유효 개통기간은 약 6-9개월로 보고되고 있다[1-3]. 이는 담도암 환자의 평균 여명인 16개월에 비해 짧은 기간으로 스텐트의 잦은 교체가 필요하다[4]. 따라서 스텐트의 유지기간을 늘리기 위하여 항 역류 스텐트, 피복 스텐트, 약물 분비 스텐트, 광역동치료 스텐트 등 다양한 방법들이 연구되고 있다[5,6].
또한, 개통기간이 환자의 상황별로 다양하여 예측하기 어렵다는 문제가 있으며 예상하지 못한 담도 스텐트의 폐쇄는 담도염과 같은 합병증을 유발하게 되고, 특히 면역이 저하된 항암 치료 환자군에서는 패혈증을 야기시키기도 한다. 더욱이 감염이 발생하면, 암환자에서 항암약제 투여를 지연시켜 항암 효과가 감소하는 문제가 생기기도 한다. 따라서 스텐트 내부가 폐쇄 상태라는 것 혹은 좁아지고 있다는 것을 미리 예측할 수 있다면, 합병증이 발생하기 전에 적절한 시술을 통해 스텐트의 개통을 유지할 수 있어 환자의 예후(prognosis) 및 삶의 질(quality of life)을 개선시킬 수 있을 것으로 기대된다. 현재로서는 스텐트의 개통 및 폐쇄 여부를 복통 및 황달 등의 주관적 증상을 바탕으로 추정하고 있으나, 구체적으로 확인할 수 있는 방법은 없는 실정이다. 이러한 스텐트의 상태를 구체적으로 예상할 수 있는 장치를 개발하고, 스텐트의 유지기간을 늘리기 위해 항균 물질을 코팅한 스텐트를 장착함으로써 이러한 미충족 수요(unmet needs)를 해결하고자 한다.
정상 및 폐쇄 및 역류성 담도염에서의 산도(pH) 측정
담도 폐쇄 혹은 염증이 발생하는 경우 pH가 변한다. 인체 내에서 생리적으로 담도 내 담즙은 pH 7.5-8.05 정도를 유지하고 있다[7]. 하지만 담도 폐쇄 발생 시 pH가 감소하게 되는데, 이는 담도보다 담즙이 축적되는 담낭에서 pH가 낮듯이 담도 폐쇄로 담즙산(bile acids)이 쌓이기 때문으로 보인다[7]. 또한, 담즙의 정체로 증식한 균들의 염증 대사 산물로 산성 물질의 영향도 있을 것이다. 폐쇄로 인한 담도 내 담즙의 pH 변화를 측정한다면, 스텐트의 폐쇄를 예측할 수 있을 것으로 예상된다. 담도 스텐트의 폐쇄 전과 후 담즙의 pH의 변화범위를 확인하여, 이에 맞는 센서의 개발이 필요할 것이다.
담도에 스텐트를 위치하게 되면, 스텐트로 인해서 십이지장 팽대부가 열려있게 됨으로써 십이장 내의 음식물이 담도 스텐트로 역류하게 된다[8]. 이러한 역류한 음식물은 담도에 염증이 생기게 하여서 역류성 담관염을 유발할 수 있다. 이런 십이지장에서 음식물은 pH 4-6 정도이기 때문에 역류 발생 시 담도 내의 pH는 급격하게 감소할 것이다[9]. 하지만 이후 알칼리성인 담즙이 분비되면서 pH는 평소의 약 알칼리 환경으로 변할 것이다. 다만, 비폐쇄 역류성 담도염이 생길 경우 담즙의 정체가 없지만 균의 대사산물이 생성되어 폐쇄성 담도염보다는 높지만 평소보다 조금 더 낮은 pH로 관찰될 것으로 생각된다.
담도 스텐트에 pH 측정을 위한 센서의 부착
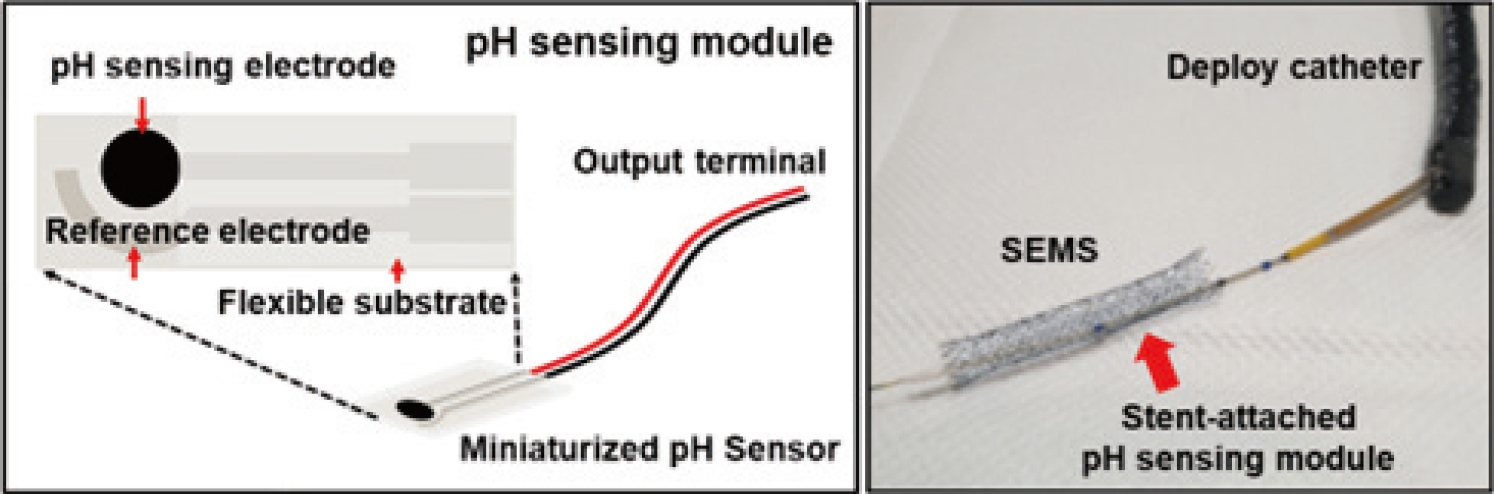
본 연구의 진행을 위해 pH 측정을 통한 담도 내부 변화를 모니터링하고 데이터를 외부로 전송할 수 있으며, 직경 1 cm의 좁은 공간의 스텐트 내부 또는 외부에도 부착할 수 있는 유연한 표면의 2전극 pH센서를 사용하고자 한다(Fig. 1). 센서 시스템은 스텐트 장착 후 스텐트 폐쇄까지 수개월이 걸릴 수 있는 점을 고려하여, 외부의 모니터링 시스템 장비를 센서에 선으로 연결된 체내 커넥터에 다가가 pH 측정을 시도하게 되면 외부에서 무선으로 일시적으로 전원을 공급하여 스텐트 내의 pH 센서가 동작을 하게 제작할 것이다. 또한, 해당 외부 센서 시스템은 pH 측정 시에만 사용되기 때문에 평소 환자가 생활하는데 있어서 사용에 대한 불편감을 줄일 수 있다는 이점을 제공한다.
다만, 측정을 위한 외부 장비와 커넥터 간의 거리를 가깝게 하기 위해서 스텐트의 센서와 얇은 전선으로 이어진 커넥터를 환자의 위벽에 클립 등을 활용하여 고정하려 한다. 이에 고정된 커넥터 부위의 통증 및 감염, 그리고 커넥터의 이탈 및 기능 장애 등의 문제가 발생할 수 있다는 점이 한계점으로 주의가 필요하다.
생체 외(in vitro) 실험
담도 스텐트의 기능을 확인할 수 있도록 생체 외 실험을 할 수 있는 담즙 흐름 모델(flow phantom model)을 사용하였다. 해당 모델은 담즙 흐름 연구에서 보고된 방법을 바탕으로 제작되었다[10]. 본 담즙 흐름 모델은 Sigma Aldrich사(Burlington, MA, USA)의 동물 담즙 분말을 용해하여 담즙을 만들고, 이를 스텐트 내부로 하루 500 mL-1 L의 담즙(사람의 1일 담즙 배출량이 600 mL가량임을 바탕으로 설정[11])을 37도의 온도로 고정하여 담즙을 담관에 해당하는 실리콘 튜브 내부로 흐르게 하였다(Fig. 2). 이런 담즙 흐름 모델에서 충분한 검증을 통해 적합성 평가 및 담도 내부 환경 모니터링의 센서 기초 운용이 가능하므로, pH 측정 담도 스텐트의 신뢰성 검증 및 생체 내(in vivo) 실험을 위한 체계적인 데이터 습득이 가능할 것이다.
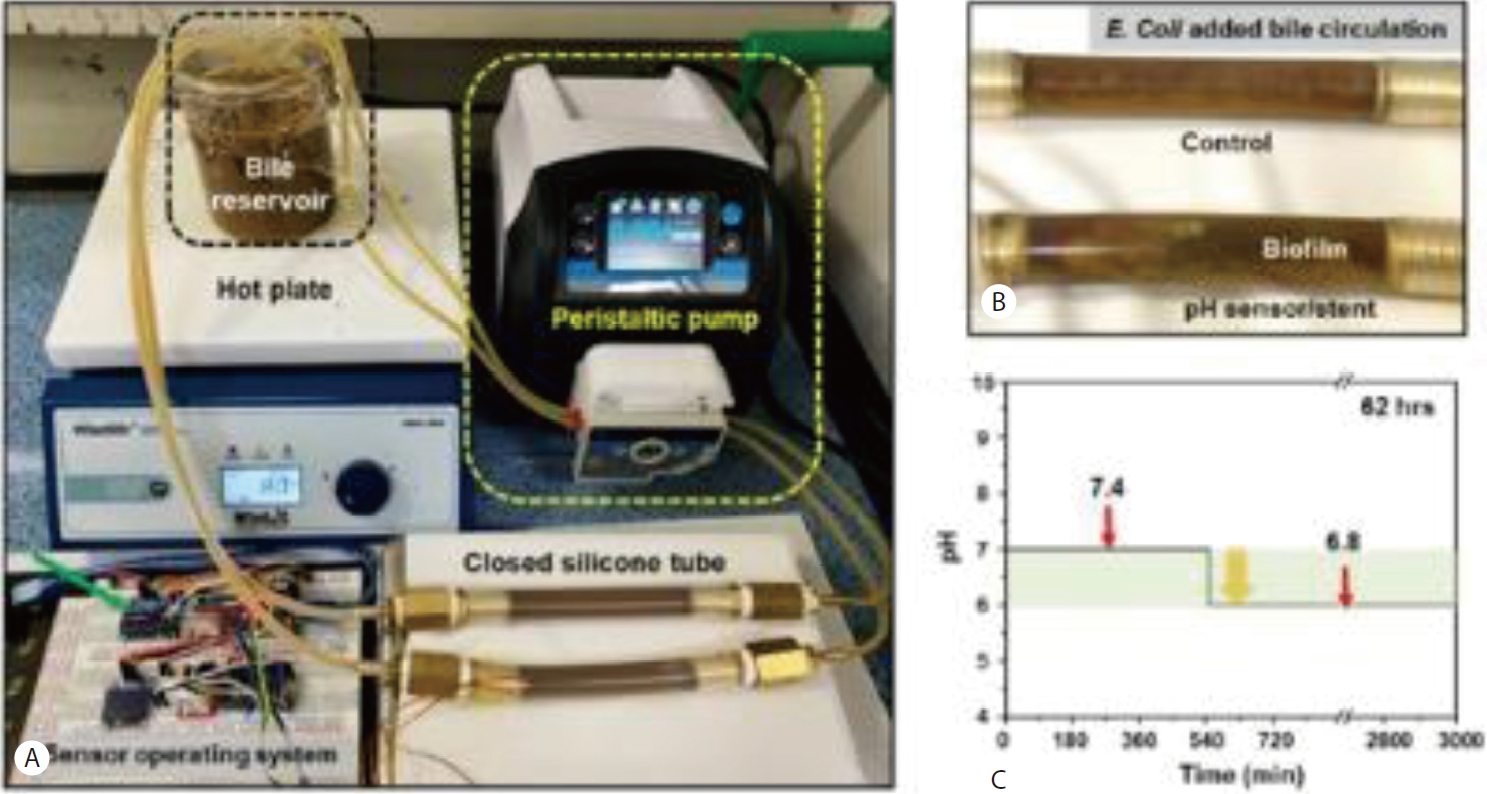
A stent evaluation system using a bile flow model. (A) A bile flow model designed to perform in vitro experiments that can verify the function of the stent in an environment similar to the in vivo bile duct. (B) An enlarged image of the silicone tube of the bile flow model. Comparison of the biofilm formation status of the silicone tube without a stent and the silicone tube with a stent equipped with a pH sensor. (C) The real time measurement of pH level in the silicone tube equipped with a stent/pH sensor.
이러한 예상을 바탕으로, 개발된 pH 센서의 기능을 확인하기 위해 담도 스텐트에 센서를 장착하여 담즙 흐름 모델(Flow phantom model)에서 생채 외 실험을 진행하였다. 해당 담즙 흐름 모델의 모니터링 시스템은 상기 센서 시스템과 다르게 외부에서 전원이 직접 공급이 되고, 이 전원을 지름 300 μm의 전선을 통해 직접 스텐트 내의 센서에 전원을 공급함으로써 측정 시간과 전원 공급에 대한 장애 없이 담도 내 스텐트 폐쇄 여부를 장기간 확인이 가능하다. 해당 모델에 스텐트를 장착한지 약 9시간 후에 Fig. 2C의 그래프와 같이 스텐트의 폐쇄가 관찰되며 pH가 7.4에서 6.8로 감소하는 것이 측정되었다. 다만, 9시간 동안 pH의 변화가 서서히 관찰되지 않고 급격한 변화로 나타났으며, 이후 총 62시간 동안 관찰 시 추가적인 pH의 변화는 관찰되지 않아 실험을 종료하였다. 이는 초소형 pH 측정 센서 개발에 따른 pH 측정 민감도가 떨어지는 것이 원인으로 생각되어 추후 보완이 필요할 것으로 보인다.
향균 스텐트
스텐트의 유지기간을 늘리는 방법으로 항균 물질을 스텐트에 도포하는 방법의 가능성을 고려해 보았다. 스텐트의 폐쇄는 담도 슬러지, 담석, 스텐트 내부로 종양의 성장 및 스텐트 내부에 박테리아가 부착하여 생물막(biofilm)이 형성됨으로 인해 일어나게 된다[12,13]. 이에 스텐트의 유지기간을 늘리기 위해서 스텐트에 종양 내 성장을 억제하기 위한 장치를 설치하거나, 약물을 입히는 것과 같은 방법들이 연구되고 있다[14]. 최근에는 이런 약물이 아닌 항균물질을 스텐트를 입혀 생물막의 형성을 줄여 스텐트의 유지기간을 늘이는 연구들도 진행되고 있다[15]. 본 연구의 스텐트에서도 유지기간을 늘이기 위해서 항균 물질을 도포하려 한다. 항균(antibacterial) 스텐트의 효능을 예측해 보기 위해, 먼저 스텐트에 코팅할 항균물질을 유리섬유에 코팅하여 Escherichia coli 배양액에 노출시킨 후 고체 배지에서 항균성 검증실험을 진행하고 최종 스텐트에 적용할 항균물질을 선정하였다. 선정된 항균물질은 스텐트에 코팅하여 E. coli 배양액에 노출시킨 후 액체 배지 및 고체 배지에서 항균효과에 대한 관찰을 진행하였으며 시간이 경과한 후 배지 평가 시, 스텐트 주위의 colony 생성이 억제된 것을 확인 할 수 있었다(Fig. 3). 이를 바탕으로, 항균물질이 스텐트의 생물막 형성을 억제하여 스텐트의 유지기간을 늘릴 수 있을 것으로 보인다.

Antibacterial test of the antibacterial particle-coated stent. (A) Antibacterial effect on an agar plate; antibacterial test by colony formation in antibacterial particle-coated film. (B) Digital image of antibacterial particle-coated stent. (C) Antibacterial effect in liquid medium. After immersing the antibacterial particle-coated stent in the Escherichia coli culture medium, the degree of opacity was apparently compared. (D) Digital image of the antibacterial particle-coated stent after spreading E. coli on the agar plate, in which a colony formation was confirmed around the stent.
pH 측정 센서를 활용한 스텐트로 담도 폐쇄 예측은 이론적으로 가능할 것으로 생각된다. 다만, 임상에 적용하기 위해서는 pH 측정 센서의 민감도를 더 높여 변화를 좀더 세밀하게 측정할 수 있어야 할 것이다. 또한, 스텐트의 삽입을 위한 기술의 향상 및 외부 베터리 활용 등의 기술개발이 함께 필요하겠다. 이러한 스텐트에 항균 물질을 코팅할 시 생물막의 형성을 억제하여 pH 측정뿐만 아니라 개통기간이 더 긴 스텐트의 개발이 가능할 것으로 기대된다.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
Acknowledgements
본 과제는2021년도 부산대학교병원 융합의학기술원 연구과제 연구비(CMIT2021-09)를 지원받아 작성되었음.