고식적 화학 요법 후 완전 관해된 췌장암 1예
A Case of Complete Remission from Pancreatic Cancer Following Palliative Chemotherapy
Article information
Abstract
췌장암은 항암화학요법의 발전에도 불구하고 여전히 예후가 좋지 않으며, 5년 생존율은 13.9%에 불과하다. 저자들은 61세 여성 환자에서 고식적 항암화학요법 후 췌장암에 대한 완전관해가 이루어진 증례를 보고하는 바이다. 환자는 1개월 동안의 소화불량과 2 kg의 체중 감소 증상을 호소하여 내원하였고, 컴퓨터 단층촬영 검사에서 췌장 머리 부위에 18 mm 크기의 종괴가 확인되었다. 혈액검사 결과에서 간 기능 검사는 정상이었으나, CA 19-9 및 CEA 수치가 각각 3,965 U/mL와 38.2 ng/mL로 상승되어 있었다. 조직 획득을 위해 내시경초음파 유도 세침흡인조직검사를 시행하였고, 병리학적 검사 결과 췌장선암으로 확인되었다. 양전자 방출 단층촬영 및 췌장 자기공명영상을 포함한 추가적인 평가를 통해 간의 6번째 분절과 복막하부 림프절에 전이성 종괴가 확인되었다. 최종적으로, 환자는 4기 췌장암으로 진단되었다. 환자에게 보존적 화학요법으로 폴피리녹스 투여하였고, 치료 1년 후 잔여 종양은 사라졌다. 이후 수술 치료를 시행하였고, 현재 보조 항암화학요법을 시행중이다. 전이성 췌장암에서 항암화학요법으로 완전관해를 이룬 사례는 매우 드문 증례이기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
The prognosis for pancreatic cancer is still poor with a 5-year survival rate around 10%. We report a case of complete remission after palliative chemotherapy for pancreatic cancer in a 61-year-old-female. She presented with indigestion and weight loss. A computed tomography scan revealed a 1.8 cm mass in the pancreatic head. Carbohydrate antigen 19-9 (CA 19-9) and carcinoembryonic antigen (CEA) levels were elevated. The patient underwent endoscopic ultrasound-guided fine needle biopsy (EUS-FNB) and the pathologic examination showed adenocarcinoma. Positron emission tomography (PET) and magnetic resonance imaging (MRI) of the pancreas showed a metastatic nodule in the S6 segment of the liver and a metastatic portocaval lymph node. The final diagnosis was stage IV pancreatic cancer. The patient received 24 cycles of palliative FOLFIRINOX regimen. Response evaluation demonstrated disappearance of all the lesions. She underwent pyloruspreserving pancreatoduodenectomy (PPPD). The pathologic examination of the surgical specimen showed complete remission of the pancreatic cancer. The patient is currently undergoing adjuvant chemotherapy.
서 론
중앙암등록본부의 통계 자료에 의하면, 2020년 기준 췌장암은 우리나라 암 발생자수 8위, 암 사망원인의 5위로, 5년 생존율이 13.9% 정도로 예후가 불량한 대표적인 암이다[1]. 진단 당시 약 80% 이상의 환자들이 근치적 절제가 불가능한 국소 진행성(locally advanced)이나 전이성(metastatic) 상태에서 진단되며, 증상 없이 초기에 발견되더라도 대부분 수술 후 재발하기 때문에 췌장암 치료에서 항암화학요법(chemotherapy)과 항암화학방사선요법(chemoradiotherapy)은 중요한 치료 전략이 된다[2]. 특히, 전이성 췌장암의 경우 고식적 항암화학요법(palliative chemotherapy)이 치료의 근간을 이룬다[3]. National Comprehensive Cancer Network (NCCN) 가이드라인에서는 고식적 항암화학요법 치료의 일차 약제로 폴피리녹스 요법(FOLFIRINOX; oxaliplatin, irinotecan, leucovorin, fluorouracil) 또는 젬시타빈(gemcitabine)과 나노입자 알부민 결합 파클리탁셀(nanoparticle albumin boundpaclitaxel) 병합요법을 권고한다[4,5].
지금까지 진행성 또는 전이성 췌장암 환자에서 고식적인 항암화학요법 이후 완전관해(complete remission)로 보고된 증례는 극히 드물었다. 이에 저자는, 다발성 림프절 및 간 전이를 동반한 전이성 췌장암을 진단받은 환자에게 고식적 항암화학요법으로 폴피리녹스 요법 치료를 시행한 후 완전관해를 보인 증례를 소개하는 바이다.
증 례
61세 여자 환자가 외부 복부 컴퓨터단층촬영(computed tomography, CT) 검사에서 췌장 두부에 약 1.8 cm 크기의 종괴가 발견되어 의뢰되었다. 환자는 약 1개월 전부터 소화불량을 호소하였고, 지난 2개월 동안 약 2 kg가량의 체중 감소가 동반되었다. 외부 복부 CT에서는 췌장의 종괴와 더불어 문맥대정맥(portocaval), 대동정맥(aortocaval) 부위 림프절 전이가 관찰되었다(Fig. 1).
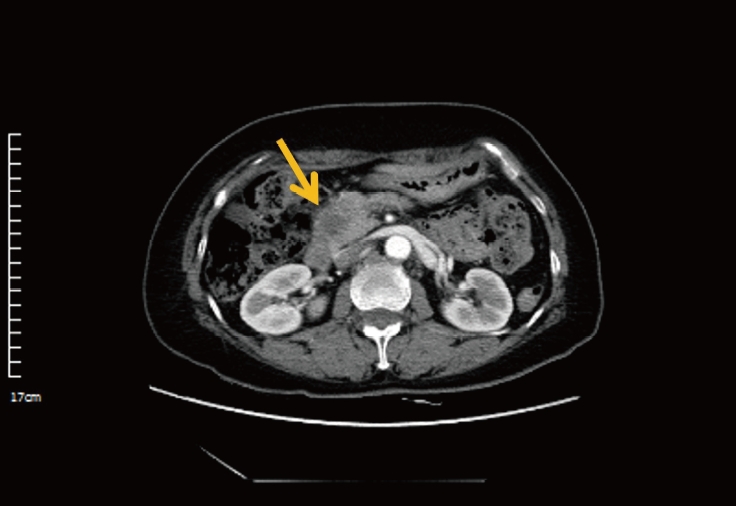
Outside hospital abdominal computed tomography findings. It shows the 1.8 cm sized hypo-attenuated lesion in the head of pancreas (yellow arrow).
환자는 고혈압과 고지질혈증의 병력이 있었으며, 복부 수술력과 췌장암의 가족력은 없었다. 술과 담배는 하지 않았다. 전원 당시 의식은 명료하였고 생체 활력지수는 혈압 158/92 mmHg, 맥박 84회/분, 호흡수 20회/분, 체온 36.7℃로 안정적이었다. 복부 검진에서 장음은 정상이었고, 명치부위 압통이나 반발통은 없었고, 촉지되는 종괴도 없었다. 말초 혈액검사에서 백혈구(white blood cell) 7,100/μL, 혈색소 (hemoglobin) 13.1 g/dL, 혈소판(platelet) 283,000/μL였다. 일반 화학검사에서 프로트롬빈시간/활성화부분트롬보플라스틴시간(prothrombin time/activated partial thromboplastin time) 11.7 s/23.6 s, 아스파트산아미노기전달효소(aspartate aminotransferase) 15U/L, 알라닌아미노기전달효소(alanine aminotransferase) 12 U/L, 알칼리성포스파타제(alkaline phosphatase) 117 U/L, 총빌리루빈(total bilirubin) 0.5 mg/dL, 아밀라아제(amylase) 49 U/L, 리파제(lipase) 29 U/L, 혈액요소질소(blood urea nitrogen) 8.9 mg/dL, 크레아티닌 (creatinine) 0.6 mg/dL, 종양표지자 검사에서는 탄수화물 항원 19-9 (carbohydrate antigen [CA] 19-9) 3,965 U/mL, 암배아항원(carcinoembryonic antigen, CEA) 38.2 ng/mL였다.
본원에서 시행한 내시경초음파 유도 세침흡인조직검사 (endoscopic ultrasound-guided fine needle biopsy) 검사에서 췌장 머리에 지름 약 2.6 cm의 둥근 모양의 불균질한 저에코의 종괴가 관찰되었고, 조직생검에서는 만성 염증 소견이었으나, 세포검사에서 유두상선에 비전형적인 세포가 확인되어 췌장샘암종으로 진단하였다(Fig. 2). 암병기결정을 위해 시행한 양전자 방출 단층촬영(positron emission tomography) 검사에서 췌장 두부 및 췌장 주변부 림프절, 간의 6분절에 국소적으로 비정상적인 F-18 fluorodeoxyglucose 섭취 증가가 관찰 되었다(Fig. 3).
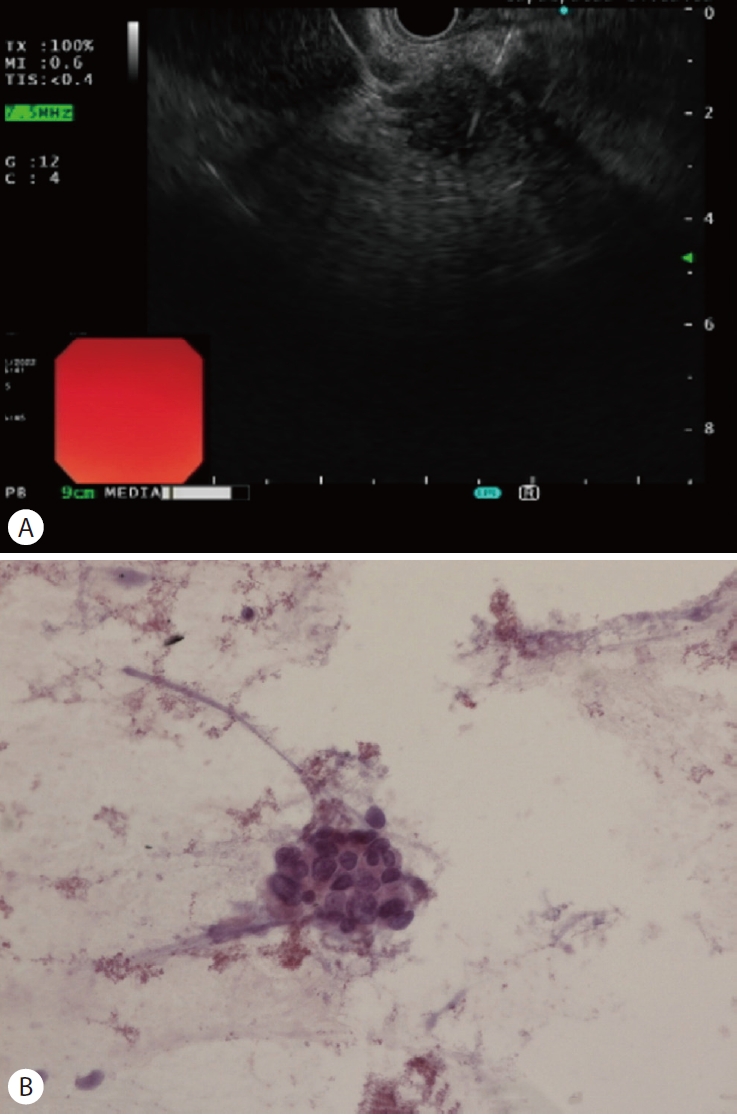
(A) Endoscopic ultrasound picture of a pancreatic head tumor. The pancreatic tumor appears as a hypoechoic round lesion about 2.6 cm in diameter. (B) Microscopic finding of pancreas needle aspiration cytology shows atypical cell in papillarygland (Hematoxylin and eosin stain, ×400).

Positron emission tomography demonstrated pancreatic adenocarcinoma with metastases. (A) Pancreatic head (yellow arrow). (B, C) Peripancreatic lymph nodes (yellow arrows). (D) Liver (segment 6) (yellow arrow).
저자들은 임상적 T4N1M1, 4기 췌장암으로 진단하고, 수술이 불가능한 진행성 췌장암에 대해 고식적 치료로 폴피리녹스 요법 항암화학요법을 시행하였다. 두 번째 주기 항암화학요법 이후 common terminology criteria for adverse events 등급 4에 해당하는 호중구 감소증(절대 호중구수[absolute neutrophil count] 367/μL)이 발생하여 이후 75%로 감량된 폴피리녹스 요법을 시행하였다. 네 번째 주기 항암화학요법 시행 이후 반응평가를 시행하였다. 복부 CT에서 췌장 두부에 종양은 기존 2.6 cm에서 1.5 cm로 줄어들었으며, 림프절 및 간 전이 병변의 크기도 감소하여 치료에 부분관해(partial remission)를 보였다(Fig. 4). 종양표지자 검사는 CA 19-9 595 U/mL, CEA 4.82 ng/mL로 감소를 보였다.
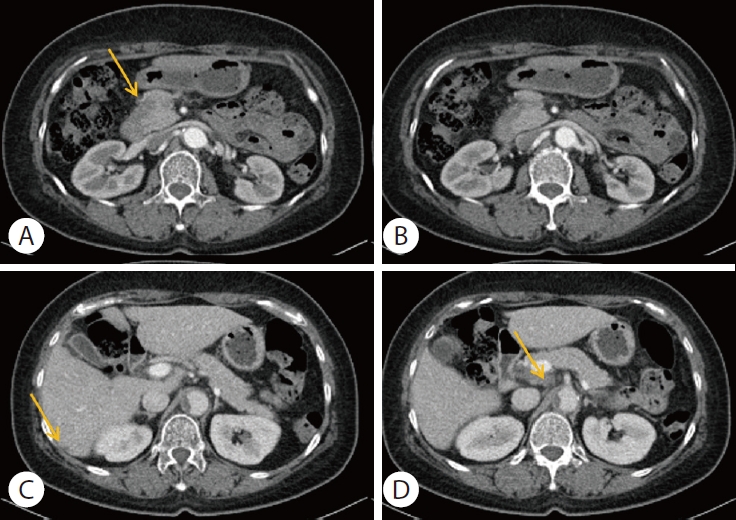
Computed tomography scan shows partial response after 4 cycles of chemotherapy with FOLFIRINOX. (A) Decreased size of pancreatic head (yellow arrow). (B) Peripancreatic lymph nodes enlargement were disappeared. (C, D) Decreased size of liver metastasis and portocaval lymph node (yellow arrow).
16번째 주기 이후 반응평가에서는 복부 CT에서 원발병소인 췌장 머리 종양은 소실되어 보이지 않았으며, 주변 림프절 및 간 전이 병변도 보이지 않아 완전관해를 보였다(Fig. 5). 종양표지자 검사에서는 CA 19-9 23 U/mL, CEA 2.76 ng/mL로 정상소견을 보였다. 폴피리녹스 요법 총 24번째 주기까지 약 10개월간 시행하였고, 반응평가에서 완전관해를 보여 병기 재평가상 절제 가능한 병기로 개선되어(downstaging), 외과와 협진하여 유문부 보존 췌두부십이지장 절제술(pylorus preserving pancreaticoduodenectomy)을 시행하였다[6]. 수술 후 병리소견에서 비전형적인 샘이 보였으나, 잔여 종양의 흔적은 없었다(Fig. 6). 수술 후 약 6주 뒤 보조항암화학요법으로 젬시타빈(gemcitabine) 투약을 시작하였으며, 수술 후 약 3개월 이상 지난 시점까지 재발없이 추적관찰 중이다.

Pylorus preserving pancreaticoduodenectomy was performed. (A) Gross pathology photo of surgical specimen. (B) Cross section of gross pathology photo of surgical specimen. (C) No viable tumor cell is detectable in the resected pancreatic head after chemotherapy (Hematoxylin and eosin stain, ×100). (D) Atypical gland is seen, but it is thought to be an artifact rather than a tumor cell (Hematoxylin and eosin stain, ×400).
고 찰
췌장암은 예후가 불량한 대표적인 암으로, 여러 종류의 췌장암 중에서 췌장 선암(pancreatic duct adenocarcinoma)이 전체의 85% 이상을 차지할 정도로 가장 흔하다[1,7]. 국소 침습(local invasion)이 없는 초기 단계의 경우 보조화학요법 (adjuvant chemotherapy)을 사용한 수술적 절제가 선택적 치료이며, 국소 침습의 단계에서는 선행보조화학요법 (neoadjuvant chemotherapy)을 통해 수술적 절제에 대한 재평가가 이루어진다[8,9]. 대부분의 환자는 진단 당시 전이성 췌장암으로 진단되며, 약 30%는 혈관 침범이 있는 국소 진행성 췌장암으로 진단된다. 따라서, 수술적 절제 가능한 췌장암 환자는 20% 정도로 낮다[1,7]. 이에 수술이 불가능한 단계에서 치료 전략으로 항암화학요법과 항암방사선요법이 포함되며, 전이성 췌장암의 경우 고식적 항암화학요법이 치료의 근간을 이룬다[3,4,6].
NCCN, European Society for Medical Oncology (ESMO), American Society of Clinical Oncology (ASCO) 등 주요 가이드라인에 따르면, 신체 활동 능력을 평가하는 European Cooperative Oncology Group (ECOG) 수행척도(performance scale) 및 동반질환(comorbidity profile)에 따라 진행성 또는 전이성 췌장암의 항암화학요법 1차 치료제를 나누는데, ECOG 수행척도가 0-1점인 경우, 세 가이드라인 모두 1차 치료 항암제로 폴피리녹스 요법 또는 젬시타빈과 나노입자 알부민 결합 파클리탁셀의 병합 요법을 쓰도록 제시하고 있다[4,9].
이러한 항암화학요법을 통해 진행성 췌장암 환자의 약 1/3이 화학요법에 반응하고 절제 가능한 상태에 도달한다. 이전 연구에서, 선행보조항암요법 후 병리학적 완전관해(pathologic complete remission)는 폴피리녹스 요법 치료 후 4.5-5.9%에서 보고되었다[10,11]. 그러나, 전이성 췌장암의 경우 고식적 항암요법 후 병리학적 완전관해를 보이는 경우는 극히 드물었다.
Luu 등[12]은 진행성 췌장암에서 폴피리녹스 요법으로 투약 후 완전관해를 이룬 1예를 보고하였다. 간문맥(portal vein)과 위십이지장 동맥을 침범한 진행성 췌장암을 진단받은 67세 여성에서, 빌리루빈 상승소견으로 폴폭스(FOLFOX; 5FU, leucovorin, oxaliplatin) 1주기 시행 후 폴피리녹스 요법 5주기 시행하였으며, 재평가에서 절제가능한 단계로 유문부 보존 췌두부십이지장 절제술을 시행하였다. 이후 병리 소견상 완전관해를 이루었다. 보조항암화학요법으로 폴피리녹스 요법 6회 시행 후 경과관찰하였고, 12개월 후 추적 복부 CT 검사상 간의 7번째 분절에서 새로운 병변이 확인되고 종양표지자 검사에서도 CA 19-9가 상승되었다. 선행보조항암화학요법 후 간 절제술을 시행하였으며, 1년 뒤 다시 하대정맥침범을 동반한 간전이, 림프절 전이로 지지요법 시행 중 사망하였다[12]. Höhn 등[13]은 33세 남성의 간전이가 동반된 전이성 췌장암 환자에서 고식적 항암화학요법으로 폴피리녹스 요법 6주기 투약 후 임상적 완전관해를 보인 증례를 보고한 바 있다. 이 환자도 본 증례와 마찬가지로 고식적 항암화학요법 후 완전관해를 보여 병기 개선 후 수술을 진행하였으며 이후 보조항암요법으로 폴피리녹스를 투약하였다. 이후 여러 차례 재발을 보여 항암화학요법과 간절제 수술, poly ADP-ribose polymerase (PARP) 억제제 투약 등 치료를 거쳐 첫 진단 후 증례가 보고된 2021년 4월까지 54개월간 생존을 보였다[13]. Atiq 등[14]은 49세 여성의 간전이가 동반된 췌장암 환자에서 고식적 항암화학요법과 면역관문억제제(immune checkpoint inhibitor) 투약 후 완전관해를 보인 1예를 보고하였다. 고식적 항암화학요법으로 1차 폴피리녹스 요법 18주기 투약 후 반응평가에서 부분반응을 이루었지만, 이후 부작용으로 폴피리녹스 요법을 중단하였다. 이후 유전자 변이 검사에서 PD-L1이 10%로 발현을 보여, 2차 약제로 면역관문억제제인 펨브롤리주맙으로 변경하여 4주기 시행 후 반응평가에서 완전관해를 보였다[14].
NCCN 가이드라인에서는 췌장암에서 항암화학요법 시행 전 체세포(somat ic) 또는 생식세포(germl ine)의 유전자 돌연변이(gene mutation) 검사를 권고한다. 이를 통해 BRCA1/2 등 유전자 변이가 있을 경우 올라파립과 같은 PARP 억제제를 유지요법 또는 2 차 약제로 투약할 수 있다[4]. 그러나, 우리나라에서 이러한 유전자 변이 검사를 진행하기에는 보험 기준을 충족시키기 어려운 상황이며, 본 증례의 경우 검사를 진행할 만큼의 충분한 체세포를 얻지 못하여 유전자 변이 검사를 시행하지 못하였다
Conroy 등[15]의 연구에 따르면, 수술 후 보조항암요법을 시행하는 것은 무병생존기간(disease-free survival)과 전체생존기간을 개선시킬 수 있다. 젬시타빈 단독 투여의 무병생존기간은 13.4개월, 전체생존기간은 22.8개월을 보였다. 폴피리녹스요법의 경우 무병생존기간은 21.6개월, 전체생존기간은 54.4개월로 젬시타빈 단독 투여에 비해 더 나은 결과를 나타내었다[15]. NCCN, ASCO, ESMO 등 주요 가이드라인에서는 수술 후 보조항암요법으로 ECOG 수행척도가 0에서 1인 경우 용량을 감소시킨 폴피리녹스 요법을 우선적으로 투여하도록 제시하며, ECOG 수행척도가 2인 환자군의 경우 젬시타빈 단독투여를 제시하고 있다[4,6,8]. 본 증례에서는 환자의 ECOG 수행척도는 1이었으나, 이전 고식적 항암화학요법으로 폴피리녹스 요법을 24차까지 시행하였으며 이후 부작용으로 호중구 감소증 및 말초 신경병증이 있었기에 보조항암요법으로 젬시타빈 단독 투여를 결정하였다.
저자들은 전이성 췌장암으로 진단받은 환자에게 항암화학요법 후 완전관해를 보여 수술을 시행하였고, 현재까지 보조항암화학요법을 유지하며 재발 없는 상태로 경과관찰 중이다.
Notes
Conflict of Interest
The authors have no conflicts to disclose.

