ERCP 연관 췌장염의 예방 및 치료
The Prevention and Management of Post-ERCP Pancreatitis
Article information
Trans Abstract
Complications that may occur after an endoscopic retrograde cholangiopancreatography (ERCP) procedure include pancreatitis, bleeding, cholangitis, cholecystis, perforation, and postERCP pancreatitis (PEP). Of these, PEP is the most common complication and 10% of patients can die from severe pancreatitis. Prevention of PEP requires the selection of an appropriate patient group according to their ERCP indications and a full awareness of the risk factors. The incidence rate can be reduced to some extent through medication and ERCP manipulation changes. The use of a spile through the guidewire during ERCP manipulation and temporary pancreatic duct stent insertion can be effective, and the administration of suppository NSAIDs as medication reduces the occurrence of PEP. Drugs such as glyceryl trinitrate (GTN), nafamostat, and somatostatin can be considered as the second best treatment in the cases where NSAIDs are contraindicated or where a plastic catheter cannot be inserted or fails after insertion into the pancreatic duct.
서 론
내시경적 역행성 담췌관조영술(endoscopic retrograde cholangiopancreatography, ERCP)은 소화기 내시경 검사 중에서 고난도의 기술을 요하며, 시술로 인한 합병증이 높은 고위험군에 속하는 대표적인 내시경 시술이다. ERCP 시술 후 발생할 수 있는 합병증에는 췌장염, 출혈, 담관염, 담낭염, 천공 등이 있으며 이 중 내시경적 역행성 담췌관조영술 후의 췌장염(post-ERCP pancreatitis, PEP)은 가장 흔한 합병증으로 환자의 10%에서는 중증의 췌장염이 발생하여 사망에 이르기도 한다.
그러므로 합병증을 줄이기 위해서는 ERCP 시술의 집중적인 수련과 경험이 반드시 따라야하며 이를 위한 질 관리가 필요하다. 이에 대한췌담도학회 정책 및 질관리위원회에서는 ERCP의 질 향상을 위해서 ERCP 시술 후 발생할 수 있는 합병증 중 췌장염의 예방과 치료에 대한 최신 지견을 소개하고자 한다.
본 론
1. 정의(definition)
ERCP 연관 췌장염(PEP)에 대한 표준화된 정의는 아직까지 없으나 2012년 미국소화기내시경학회에서는 1) ERCP 후 새로 또는 악화된 복통이 있으면서, 2) 최소 2일 이상 입원을 요하며, 3) 혈청 amylase가 정상 상한치의 3배 이상 증가된 경우를 ERCP 연관 췌장염(PEP)이라 정의하였다[1].
췌장염 중증도에 대해 Cotton 등2은 중증도를 입원 기간 및 동반된 합병증에 따라 분류하였는데, 경증은 입원 기간이 3일 이내, 중등증은 4일에서 10일, 그리고 중증은 10일을 초과하는 경우를 말하며, 출혈성 췌장염, 췌장 궤사, 가성낭종이 발생되는 경우 또는 배액술 또는 수술적인 처치가 필요한 경우를 중증이라 정의하였다(Table 1).
2. 유병률(epidemiology)
췌장염은 ERCP의 가장 흔하고 심한 합병증 중의 하나이며 진단적 ERCP에서 0.4-1.4%, 치료적 ERCP에서 1.6-5.4%로 다양하게 보고되고 있다[3]. ERCP를 시행 후 환자의 75%에서 amylase가 상승할 수 있으나[4] 전부 PEP의 정의에는 부합하지는 않는다. PEP의 전체적인 발생빈도는 서구에서 21개의 전향적 연구를 메타분석한 결과 약 3.5% (1.6-15.7%)로 보고되었으며[4,5]. 일본에서 21개의 센터에서 분석한 연구 결과 약 1.1%로 보고 되었다[3]. 소아에서의 PEP 유병률은 성인과 유사한 빈도를 보였다[6].
중증도에 따른 PEP 유병률은 경증은 45%, 중등증은 44%, 중증 췌장염은 11%로 보고되었으며 PEP 환자의 사망률은 약 3% (95% confidence interval [CI], 1.65-4.51%)[7]로 전체 ERCP 환자의 사망률인 0.02%에 비해 월등히 높았다[8]. 국내에서 PEP 유병률은 약 3.6-16.5%로 보고자에 따라 다양하였다[9-13].
3. 위험인자(risk factors)
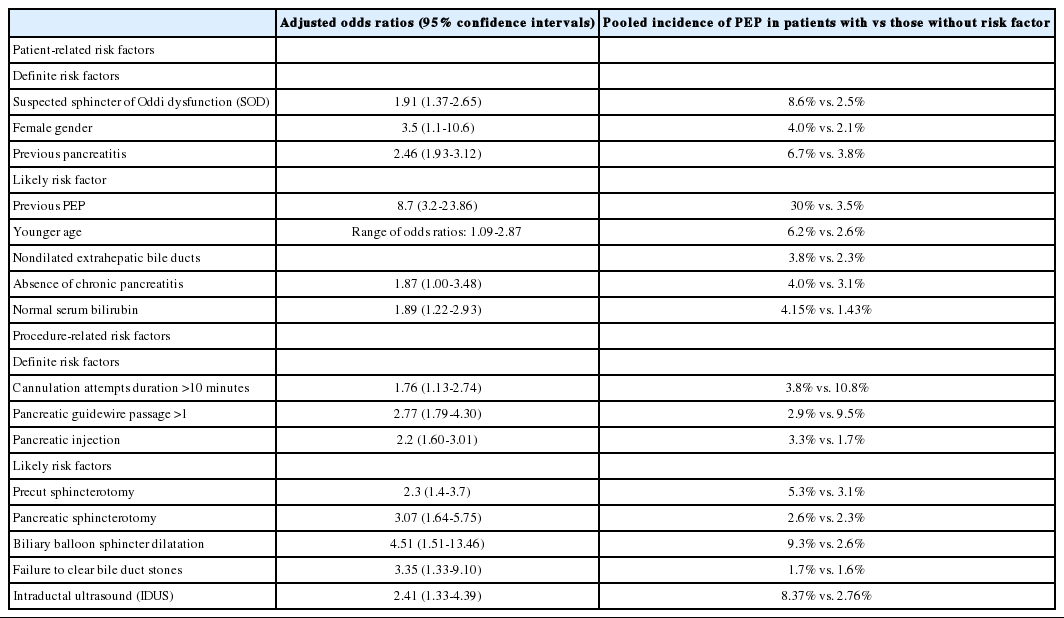
PEP의 위험인자로는 풍선확장술(balloon dilatation of biliary sphincter), PEP의 과거력이 있는 경우, 정상빌리루빈 수치, 췌관 조영제 주입, 췌관괄약근절개술(pancreatic sphincterotomy), precut sphincterotomy, 오디괄약근 기능 이상이 의심되는 경우, 젊은 성인 등으로 보고하였다[4,14,15].
이후 2014년에 ESGE 가이드라인에서는 최근 문헌들을 토대로 위험인자에 대한 내용을 새롭게 발표하였다(Table 2) [16].
ESGE 가이드라인의 특징은 환자인자와 시술인자로 분리하였고 확실한 위험인자와 가능성이 높은 위험인자를 분리하였다는 점이다. 환자인자는 오디괄약근 기능 이상 의증, 여성 및 췌장염의 과거력이고 시술 관련 인자로는 10분을 초과한 삽관시도, 1회를 초과하여 췌관에 유도선이 삽입된 경우, 췌관 조영된 경우 등이다.
이에 비해 랑데부술기(rendezvous procedures)는 PEP의 위험을 줄인다고 보고하였으며[17] needle-knife를 이용한 유두부절개술은 위험인자가 아닌 것으로 보고하였다[18,19].
관강내세경초음파(intraductal ultrasound)가 PEP의 위험인자인지에 대해서는 아직 명확하지 않으나 2,364건의 ERCP를 시행받은 환자를 대상으로 후향적, 다변량 분석하였을 때 위험인자에 해당된다고 보고하였다[20].
4. PEP 예방의 약물치료(pharmacologic agents available for PEP prophylaxis)
ERCP 후 췌장염을 예방하기 위한 약물에 대한 연구들은 지금까지 활발히 이루어지고 있으며 저자는 최근에 발표된 문헌들을 토대로 효과가 입증된 약제, 유효할 것으로 생각되는 약제, 효과가 없는 약제로 구분하여 설명하고자 한다.
1) 효과가 입증된 약제(drugs with proven efficacy)
NSAIDs
NSAIDs는 phopholipase-A2를 억제하여 염증을 유발하는 지질의 생성을 억제하며 diclofenac이나 indomethacin을 직장내 투여하면 PEP의 발생을 줄인다고 알려져 있어 임상에서 널리 사용되고 있다[21-23].
2009년부터 2014년까지 발표된 6개의 메타분석들은 NSAID 투여군이 대조군보다 중증도에 관계없이 모든 PEP 예방에 효과적이었다고 보고하였다(Table 3)[21,24-28].
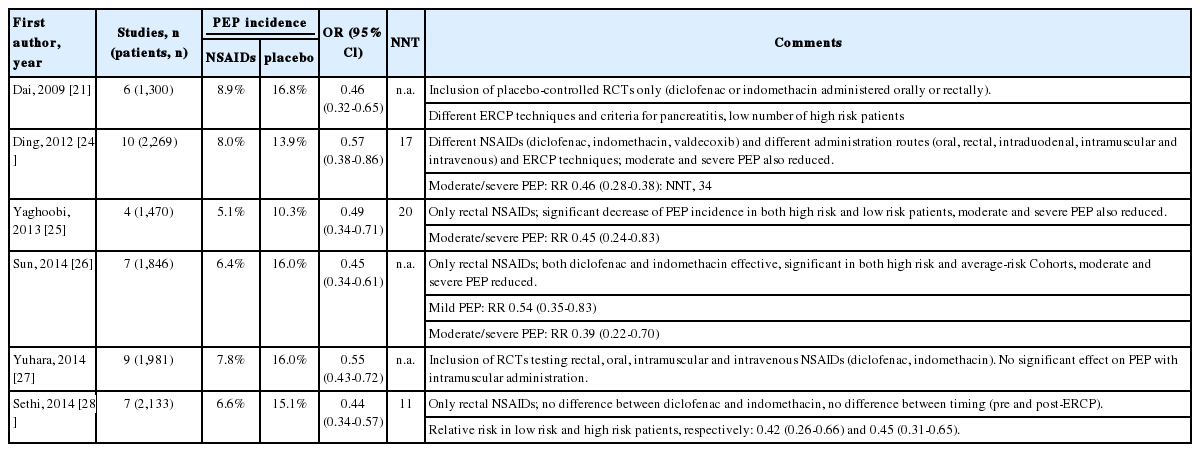
Meta-analyses published in 2009 or later that assessed the effect of NSAIDs on post-ERCP pancreatitis (PEP)
우리나라 환자를 대상으로 한 연구 결과를 보면 PEP는 indomethacin군에서 9.2% (27/295명), 위약군에서 16.9% (52/307명)로 indomethacin은 PEP의 절대적 발생 위험도를 7.7%, 상대적발생 위험도를 46%나 감소시켰다[29].
2) 효과가 예상되는 약제들(possibly effective drugs)
Somatostatin과 octreotide
췌장 소화효소의 분비를 감소시키는 somatostatin과 octreotide에 대한 메타분석 결과를 보면 somatostatin은 PEP의 발생위험을 줄이는데 효과적인데 비해 octreotide는 효과가 없었다(relative risk [RR] 0.52, 95% CI 0.30-0.90 versus RR 0.86, 95% CI 0.45-1.63, respectively)[30].
특히 somatostatin 3 mg을 12시간에 걸쳐 주입하거나 250 μg을 bolus로 주입하였을 때 효과적이었으며, 저위험군보다 고위험군(조영제의 췌관주입, 담도괄약근절개술)에서 좋은 효과를 보였다. 반면 octreotide는 고용량을 투여할 때 PEP 예방 효과가 좋은 것으로 분석되었으며(oddi ratio 0.42: 95% CI 0.20-0.90)[30] 최근에 발표된 somatostatin과 대조군의 비교연구에서도 somatostatin은 ERCP 후 PEP 발생을 감소시켰다고 보고하였다(4.0% vs. 7.5% [95% CI 2.6-6.3%; P=0.03])[31].
이러한 연구 결과를 바탕으로 somatostatin은 NSAIDs 금기증이나 췌관에 플라스틱도관 삽입이 불가능하거나 실패한 경우에 차선책으로 250 μg somatostatin을 bolus로 투여하는 것을 고려해 볼 수 있다.
단백분해효소 억제제(protease inhibitor)
단백분해효소 억제제인 gabexate나 ulinastatin의 PEP 예방효과는 4개의 메타분석과[27,32-34] 잘 고안된 8개의 randomized controlled trial (RCT) 연구(Jadad score >3) 결과를 보면 gabexate나 ulinastatin은 PEP의 위험을 줄이지 못하여서 두 가지 약제 모두 사용은 권고되지 않는다.
새로운 단백분해효소 억제제인 nafamostat의 유용성에 대해서는 2,678명의 환자를 대상으로 한 5개의 RCT를 메타분석한 연구에서 PEP의 발생을 낮추었다고 보고하였고(RR 0.47; 95% CI 0.33-0.67)[27] 3개의 RCT 연구에서 nafamostat가 고위험군이 아닌 저위험군에서 PEP의 risk를 줄이는데 효과가 있었다고 보고하여[35-37] nafamostat의 유용성에 대해서는 좀 더 추가 연구가 필요할 것으로 생각한다.
오디괄약근의 압력에 영향을 주는 약제(drugs influencing sphincter of Oddi pressure)
Nitroglycerin은 PEP의 발생률을 줄이지만 설하투여가 아닌 경피로 투여하는 경우에는 효과가 없으며 부작용으로 저혈압, 두통이 유발되므로 nitroglycerin을 일상적으로 사용하는 것을 권고하지 않는다.
그러나 최근 총 1,920명의 환자를 대상으로 한 8개의 RCT 연구를 메타분석한 자료를 보면 glyceryl trinitrate (GTN)은 대조군과 비교하여 유의하게 PEP 발생률을 줄였으며(5.9% vs. 9.8% P=0.002) [38] 다른 문헌에서도 중등도나 중증의 PEP에는 효과가 없었으나 경증의 PEP는 발생률을 줄이는데 효과적이라고 보고하였다(RR 0.67; 95% CI, 0.52-0.87) [39].
그리고 GTN의 투여방법에 따라 효과가 달랐는데 설하투여가 경피투여나 국소투여보다 더 효과적이었다. 이러한 연구결과를 근거로 NSAIDs의 금기증에 해당되거나 췌관에 플라스틱도관 삽입이 불가능하거나 실패한 경우 차선책으로 glyceryl trinitrate를 설하투여할 것을 고려할 수 있다.
3) 효과적이지 않은 것으로 밝혀진 약제들(drugs proven ineffective)
Glucocorticoids, 오디괄약근의 압력을 줄이는 약제(botulinum toxin, lidocaine, nifedipine), 항산화제(allopurinol, N-acetylcysteine, natural beta-carotene), 헤파린(heparin), IL-10, 몇몇 항염증제(diclofenac, indomethacin을 제외한 pentoxifylline, semapimod), recombinant platelet-activating factor acetylhydrolase (PAF-AH)는 최근의 연구에서도 PEP의 발생을 줄이지 못하였으므로 사용을 권고하지 않는다.
5. ERCP 수기 변경을 통한 방법
1) 일반적 고려사항
ERCP시 환자의 자세는 PEP 발생과는 관련이 없다. 154명을 대상으로 한 2개의 연구에서 전체 PEP 발생은 2.4%였으며 앙아위(supine)와 복위(prone)에서 PEP 발생은 차이가 없었다[43].
ERCP시 담도 삽관은 최소화되어야 하며, 특히 췌관의 조영 횟수와 조영제의 양을 최소화하여야 한다[44]. 어려운 담도삽관(difficult biliary cannulation)이란 삽관 시도 10-15회 이상 또는 시술 후 10분이 경과해도 성공하지 못한 경우, 그리고 원하지 않는 관으로 5회 이상 삽관이 된 경우를 말한다.
사용되는 조영제의 종류, 즉 고삼투압 조영제 및 저삼투압 조영제에 따른 PEP 발생의 차이는 없었다[45].
2) 췌관 스텐트의 삽입
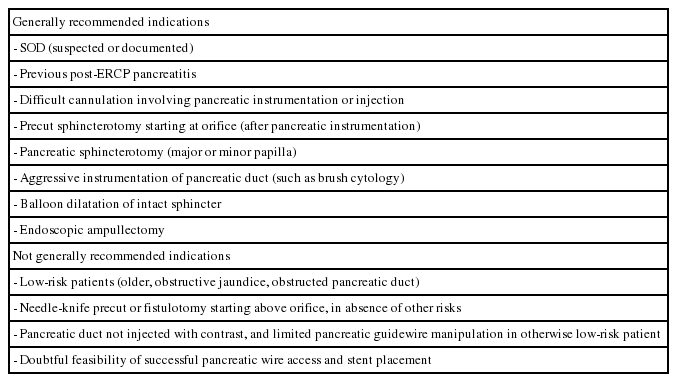
많은 전향적인 연구들은 고위험군 환자에서 일정기간 췌관 스텐트를 유지시키는 것이 PEP의 빈도와 중증도를 줄이는데 효과적이라고 보고하였다. PEP 고위험은 manometry로 SOD가 진단이 되었거나 의심되는 경우, endoscopic ampullectomy, pancreatic sphincterotomy, precut sphincterotomy, pancreatic brush cytology, difficult biliary cannulation, 췌관에서 유도선을 조작하는 경우, 과거 PEP 병력이 있는 경우, 정상적인 유두부에 풍선확장술을 시행한 경우 등이다(Table 4) [3,46,47].
8개의 연구에서 680명을 대상으로 분석한 결과를 보면 췌관 스텐트를 삽입한 그룹이 대조군에 비해 PEP 발생률이 낮았으며(19% vs. 6%) [48] 경증 및 중등증 췌장염의 발생률이 낮았고(5.8% vs. 13.1%) 중증 췌장염은 한 예도 없었다[3]. 결국 PEP의 위험도가 높은 경우 췌관 스텐트를 예방적으로 삽입하는 것이 비용효과 측면에서 우수하였다[49,50].
한편 PEP 발생 고위험군에서 췌관에 대한 선택적 삽관이 이루어지지 않는 경우에는 guide wire를 통한 삽관을 시도해 볼 수 있으며 최소한의 접근(약 5회 이하)을 시도해야 하며 최소한의 조영제를 사용하는 것이 좋다. 만약 쉽게 삽관이 되지 않으면 조기에 췌관 삽관 시도를 중단하는 것이 오히려 PEP를 발생을 줄일 수 있다.
췌관 스텐트는 주로 5 Fr 또는 3 Fr를 사용하는데, 두 종류의 성적에는 차이가 없었으나 5 Fr 스텐트가 더 선호되었다[51]. 사용 길이는 2 cm 또는 3 cm가 많이 사용되었으며 내부 flange가 없는 것을 더 많이 사용하였다. 삽입 후 5-10일 후에 저절로 배출이 되지 않으면 스텐트로 인한 PEP 증가 또는 췌관 손상을 막기 위해서 내시경으로 제거를 해야 한다[51,52].
3) Wire-guided cannulation
조영제 주입하기 전 유도선을 통해 삽관을 확인하는 것이 여러 연구에서 담도의 선택적 삽관의 성공률을 높이고 췌관 조영을 줄여 PEP의 발생률을 낮춘다고 보고하였다[53,54]. 그러나 췌관으로 부주의하게 유도선이 삽관되는 경우 PEP의 위험인자라는 점은 고려해야 한다[55,56].
4) Pancreatic guide wire-assisted technique
췌관으로 guide wire가 의도하지 않게 삽입이 되면서 담관으로 선택적 삽입이 되지 않는 경우에는 췌관에 wire를 거치해 놓고 다시 담관으로 삽입을 시도할 수 있다(double guide wire technique). 이런 경우에는 췌관에 삽입된 wire로 인해 PEP 발생 가능성이 많으므로 췌관 스텐트를 삽입하는 것이 권고된다(2.9% vs. 23%) [47,57].
5) Precut biliary sphincterotomy
어려운 담도 삽관시 구조 시술(rescue therapy)로 시행되는 precut biliary sphincterotomy는 전통적으로 PEP 발생을 높이는 것으로 보고되고 있으나[44,58] precut 그 자체보다도 어려운 담도 삽관으로 인한 장시간의 삽입 시도로 인한 것으로 생각되고 있다. 한 연구에서 조기 precut을 한 군이 표준 시술을 하다가 precut을 시행한 군보다 PEP 발생률이 낮다고 보고하였다(2.8% vs. 6.4%)[58-61]. 그 외 유두부 입구를 직접 접촉하지 않는 fistulotomy가 PEP 발생을 낮춘다고 하나 추후 연구가 필요하다.
6) Electrocautery setting
유두괄약근절개시 electrosurgical current의 종류는 PEP의 발생에 영향을 주지 않으며, 출혈 발생 고위험군에서는 유두괄약근절개술을 할 때에는 blended current를 사용하는 것이 권고된다[62].
결 론
최근 PEP의 기전이 많이 밝혀지고 있으나 PEP의 발생률은 여전히 높으며 ERCP의 가장 흔한 합병증이다. PEP를 예방하기 위해서는 먼저 ERCP 적응증에 따른 적절한 환자군을 선택하여야 하며 위험인자에 대해 잘 숙지하고 있어야 한다. 또한 약물치료와 ERCP 수기 변경을 통해 발생률을 어느정도 줄일 수 있으며, ERCP 수기중 유도선을 통한 삽관과 일시적인 췌관 스텐트 삽입이 효과적이었으며 약물 치료로는 NASIDs의 직장내 투여가 PEP의 발생을 줄이는 것이 입증되었다. 반면 Somatostatin,octreotide, nafamostat, glyceryl trinitrate (GTN)의 약물들은 일부의 환자에서 효과가 있었으며 Glucocorticoids, 오디괄약근의 압력을 줄이는 약제(botulinum toxin, lidocaine, nifedipine), 항산화제(allopurinol, N-acetylcysteine, natural beta-carotene), 헤파린(heparin), IL-10, 몇몇 항염증제(diclofenac, indomethacin을 제외한 pentoxifylline, semapimod), recombinant platelet-activating factor acetylhydrolase는 최근의 연구에서도 PEP의 발생을 줄이지 못했다.
Notes
Conflict of Interest
The author has no conflicts to disclose.