내시경 초음파 유도하 고주파열치료
Endoscopic Ultrasound-Guided Radiofrequency Ablation
Article information
비침습적 치료가 강조되는 최근 추세로 인해 내시경 초음파(endoscopic ultrasound, EUS)를 이용한 중재시술의 필요성은 더욱 증가되고 있으며 수년 전부터 고주파열을 이용한 EUS 유도하 국소 췌장 치료법이 개발되어 대동물에서의 전임상실험과 일부 임상 적용 사례가 보고된 바 있다[1]. 본고는 EUS-guided radiofrequency ablation(EUS-RFA)을 소개하고, 현재 연구 개발 진행 상황을 보고하고자 한다.
고주파열치료(radiofrequency ablation, RFA)는 목표하는 병변 위치에 RFA 전극을 삽입한 후 고주파 전류를 가하여 암세포 내의 이온 불안정을 유발하여 세포 손상을 주고 조직 괴사를 일으키는 치료법으로, 바렛 식도와 같은 양성 질환 및 수술이 어려운 간세포암 등에서 최소 침습 치료법으로 이용된다. EUS-RFA는 위 및 십이지장의 경벽을 통해 직접적으로 췌장 및 췌장 주위 종양에 접근하여 RFA를 시행하는 방법이다. 먼저 EUS 하에서 병소를 확인하고 RFA 전극을 병변 내에 위치시킨 후 정해진 설정값에 맞추어 부채꼴 모양으로 방향을 다르게 하며(fanning technique) 종양 전체에 RFA를 시행한다(Fig. 1). 두 가지 RFA 방법이 있는데, EUSRA electrode®(Taewoong Medical, Gimpo, Korea)는 국내 기술로 개발된 제품으로 냉각장치와 일체형으로 제작된 EUS용(19G 또는 18G) 미세세침 RFA 장비를 사용하고, 5 mm, 10 mm, 15 mm, 20 mm의 4가지 형태가 있으며, 20-50 W, 10-15초의 설정값으로 RFA를 시행한다(Fig. 2) [2]. Habib EUS-RFA® (EMcision Ltd, London, UK)는 EUS에 이용되는 19G 또는 22G 미세세침 안으로 1 Fr (0.33 mm) 단전극(monopolar) RFA 기기를 삽입하여 10 W, 120초의 설정값으로 RFA를 시행한다. Habib EUS-RFA®의 경우는 미세세침을 이용하기에 EUS로 접근이 어려운 췌장 구상돌기(uncinate process) 등에서 좀 더 쉽게 사용할 수 있으나, 1 Fr 크기의 가느다란 구조이기에 쉽게 파손되어 추가적인 시술이 어려울 수있다[3]. 그에 반해 EUSRA®는 일체형으로 췌장종양 등에 반복적인 RFA 시술이 가능하지만 상대적으로 췌장 구상돌기나 두부의 시술에는 어려움이 있다.

A radiofrequency ablation needle was inserted into the pancreatic mass under endoscopic ultrasonography guidance. Ablation is indicated by hyperechoic cloud. Additional pass can be made to ablate other area in the same lesion. Courtesy of Taewoong Medical (Gimpo, Korea).
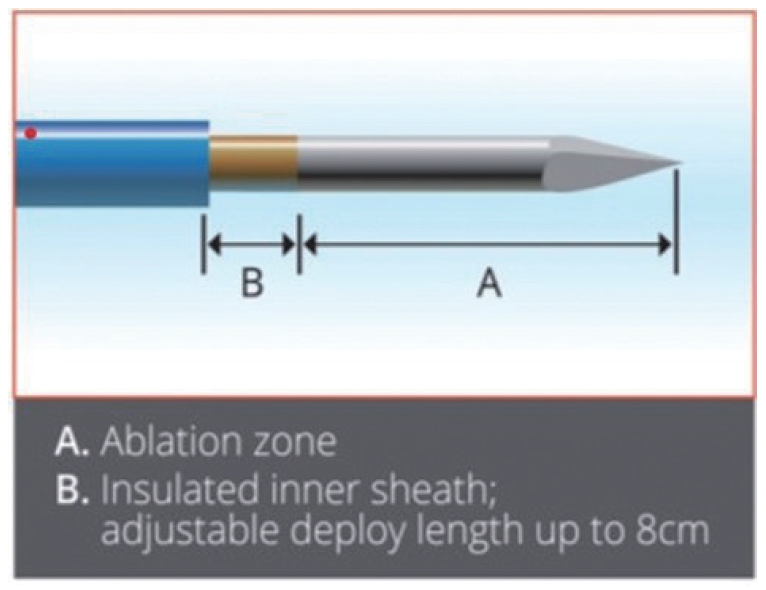
EUSRA® endoscopic ultrasound guided radiofrequency ablation electrode. Courtesy of Taewoong Medical (Gimpo, Korea).
최근 여러 연구 결과가 발표되고 있는데, Scopelliti 등[4]의 연구와 Song 등[5]의 연구에서는 수술이 불가능한 췌장암 환자에서 EUS-RFA의 기술적 안전성을 확인할 수 있었다. 췌장신경내분비종양과 췌장낭성종양같은 양성췌장종양에서도 EUS-RFA의 치료 성적이 발표되었다[6,7]. Barthet 등[7]의 연구에서는 RFA 전에 직장내 indomethacin 투여와 더불어 췌장 낭종액을 완전히 흡인하여 시술에 따른 합병증의 위험도를 낮추었다. Choi 등[8]의 국내연구에서는 신경내분비종양 환자 8명과 가성유두상종양 환자 2명을 대상으로 EUS-RFA 치료 후 약 13개월간 추적 관찰을 수행하였으며, 그 결과 70% 환자에서 종양이 제거되고, 30% 환자에서 종양 크기가 현저히 감소하였음을 확인하였다. 시술 연관 합병증은 보존적 치료로 호전된 췌장염 1예와 시술 연관 복통 1예로 확인되었다. RFA 후 조영증강 EUS(contrast-enhanced EUS)를 시행하였을 때 조직 괴사 부위에는 조영증강이 되지 않아 초기 유효성 평가에 도움이 되고, 잔존 종양이 확인되면 조영증강 EUS 하에 RFA를 추가적으로 시행할 수 있다[9]. EUS-RFA의 임상 연구는 대부분 소규모 연구 결과들이지만, 여러 보고에서 기술적 안전성은 검증되었다. 그러나 RFA는 심박동기를 장착한 환자, 응고장애를 앓는 환자, 임산부 환자에서는 사용이 어렵고, 시술 후 통증, 급성 췌장염, 췌관 협착, 출혈, 천공, 사망까지 이어질 수 있는 중대한 합병증의 위험이 있기 때문에 시술에는 세심한 주의가 필요하다.
EUS-RFA는 최소 침습적인 치료법으로 비교적 안전하고, 치료 효과를 기대할 수 있어 향후 수술 고위험군에서 수술적 치료를 대체할 수 있는 치료법으로 기대된다. 그러나 아직은 시작 단계로서, 대규모 환자를 대상으로 장기간 치료 효과에 대한 연구 결과가 없는 상태이다. 국내에서는 2020년에 증상이 있는 2 cm 이하의 인슐린종 환자를 대상으로 EUS-RFA를 사용할 수 있도록 신의료기술로 지정되었다.
Notes
Conflict of Interest
The author has no conflicts to disclose.
