췌장 낭성 종양으로 오인된 췌장 내 부비장의 유표피 낭종 2예
Two Cases of Epidermoid Cysts in the Intrapancreatic Accessory Spleen Mimicking Pancreatic Cystic Neoplasm
Article information
Abstract
부비장은 정상인의 약 10%에서 발견되고 약 16%에서 췌장에서 발견되는 것으로 알려져 있다. 그러나 췌장 내의 부비장에서 발생한 유표피 낭종은 극히 드물고 특이적 방사선 소견이 없어 진단하기 매우 어려워 췌장의 낭성 종양으로 오진하기 쉽다.
저자들은 우연히 발견된 췌장 미부의 낭성 종괴에 췌장 낭성 종양 의심하에 원위부 췌장절제술을 시행하였으나 수술 후 병리학적인 검사상 췌장 내 부비장에서 발생한 유표피 낭종으로 진단된 증례를 2예를 경험하였기에 문헌고찰과 함께 보고하는 바이다. 췌장 내 부비장의 유표피 낭종은 영상학적인 검사나 임상양상을 통해서는 다른 췌장의 낭성 종양과 쉽게 구분할 수가 없으며 따라서 췌장 낭성 종양에 대한 감별진단으로 췌장 내 부비장의 유표피 낭종의 가능성도 고려가 필요하겠다.
Trans Abstract
Epidermoid cyst in the intrapancreatic accessory spleen is extremely rare condition which could be mistaken for pancreatic cystic neoplasm. We report two cases of epidermoid cysts of intrapancreatic accessory spleen which mimicking pancreatic cystic neoplasm. Two patients, both male, aged 47 and 53 respectively were referred to our department for pancreatic mass. One was asymptomatic, whereas the other presented worsening abdominal pain and progressive weight loss. In both cases, the mass with cystic component was detected in the pancreatic tail in a computed tomography scan. Under a suspicion of pancreatic cystic neuronendocrine tumor, they underwent a distal pancreatectomy. Pathologic feature of resected specimens were shown to benign squamous lined cyst with splenic tissue in and around cyst wall which suggested that epidermoid cysts in the accessory spleen. We should take into account the possibility of epidermoid cyst in the intrapancreatic accessory spleen in the differential diagnosis of pancreatic cystic lesion.
서 론
부비장(accessory spleen)은 정상인의 약 10%에서 발견되며 약 80%에서 비장문(splenic hilum) 주위에 위치하고 약 16%에서 췌장에서 발견되는 것으로 알려져 있다. 그러나 췌장 내 부비장이 유표피 낭종을 형성하는 경우는 매우 드물다[1]. 췌장 내 부비장의 유표피 낭종은 1980년 Davidson 등에 의해 처음으로 보고된 이후 약 32증례가 보고되었으며, 우리나라에서도 5예가 보고된 바 있다[2-7]. 이러한 유표피 낭종은 흔히 췌장 종양 또는 가성낭종 등으로 오진되기도 하여 감별진단을 요하며 대개 특이적 방사선 소견이 없고 경피적 침생검으로 진단이 어려워 수술 후에 진단되는 경우가 대부분이다.
저자들은 췌장 내 부비장에서 발생한 유표피 낭종 2예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
증례 1
47세 남자 환자가 건강검진 목적으로 시행한 복부 전산화 단층촬영 검사에서 췌장 미부의 종괴가 발견되어 내원하였다. 복통, 복부 불편감 등의 증상은 없었고 과거력 상 당뇨, 고혈압이 있었다. 흡연, 음주는 하지 않았고 가족력 상 아버지가 간암이 있었다. 신체검진에서 복부팽만은 관찰되지 않았고, 압통과 반발통은 없었으며 복부의 종괴 등은 만져지지 않았다. 말초혈액검사에서 백혈구 6,620/mm3, 혈색소 15.3 g/dL, 혈소판은 286,000 /mm3이었으며, 일반화학검사에서 AST (aspartate aminotransferase) 37 IU/L, ALT (alanine aminotransferase) 78 IU/L, ALP (alkaline phosphatase) 46 IU/L, total bilirubin 1.0 mg/dL, total protein 8.2 g/dL, albumin 5.0 g/dL, amylase 45 U/L, lipase 27 U/L로 특별한 이상은 보이지 않았다. 종양표지자 검사에서는 CEA 1.1 ng/mL (정상범위 0-6 ng/mL), CA 19-9 50 U/mL (정상범위 0-37 U/mL), Chromogranin A 33.36 ng/mL (정상범위 27-97 ng/mL)로 CA 19-9의 경한 상승 소견이 있었다.
외부병원에서 시행한 복부 전산화단층촬영 검사소견을 검토한 결과 췌장 미부에 약 2.1 cm 크기의 부분적으로 조영증강을 보이는 낭성 결절이 관찰되었다(Fig. 1A). 복부 자기공명영상 검사를 시행하였으며 T2 강조영상에서 췌장 미부의 종괴는 높은 신호강도 소견을 보였다(Fig. 1B). 이 낭성 결절은 낭종이 T1 강조영상에서 물과 같은 정도로 낮은 신호강도가 아니고 낭벽이 고르지 않으면서 결절성을 보여 낭성 변화가 있는 고형 종양 가능성이 높았다. 또 이런 고형 종양 중 전산화단층촬영에서 조영증강을 보이는 것은 신경내분비종양의 특징으로 이 종괴가 낭성 변화를 보이는 신경내분비종양의 가능성이 있다고 판단되어 원위부 췌장절제술을 시행하였다.

(A) Abdominal computed tomography demonstrates 2.1 cm sized mainly cystic nodule with focal enhancing portion in pancreas tail. (B) Magnetic resonance imaging demonstrates cystic lesion showing high-signal intensity on T2-weighted images.
수술 후 절제된 조직의 육안 소견은 표면이 매끄럽고 경계가 잘 지어지는 2.3 × 1.8 × 1.7 cm 크기의 다방성의 낭종으로 낭종의 내부에서 흡인되는 물질은 없었다. 현미경 소견에서 다층의 편평상피로 내벽이 구성된 낭종과 그 주위로 비장조직이 관찰되어 췌장 내 부비장에서 발생한 유표피 낭종에 합당한 소견이었다(Fig. 2).

Pathologic features. (A) Cross section of resected specimen shows a multilocular cyst, well-demarcated from the surrounding pancreatic parenchyma. Microscopically, (B) the cyst is surrounded by a thick fibrous layer with splenic tissue in and around cyst wall (H-E, ×10). (C) Intrapancreatic accessory spleen contains white and red pulp (H-E, ×100). (D) The cyst is lined by stratified squamous epithelium (H-E, ×100).
증례 2
53세 남자가 소화불량과 약 5 kg 가량의 체중감소로 외부병원에서 복부 전산화단층촬영 검사를 시행하였고 췌장 미부에 종괴가 발견되어 본원으로 의뢰되었다. 과거력에서 심방세동이 있었고 흡연, 음주는 하지 않았다. 신체검진에서 특별한 이상소견은 관찰되지 않았으며, 말초혈액검사에서 백혈구 5,500/mm3, 혈색소 14.4 g/dL, 혈소판은 154,000/mm3로 정상범위였으며, 일반화학검사에서 AST 25 IU/L, ALT 19 IU/L, ALP 59 IU/L, total bilirubin 0.7 mg/dL, total protein 6.6 g/dL, albumin 4.4 g/dL로 정상 소견이었다. 종양표지자 검사에서는 CEA 1.5 ng/mL, CA 19-9 120.6 U/mL, Chromogranin A 124.74 ng/mL로 CA 19-9와 Chromogranin A의 경한 상승 소견이 있었다.
외부병원에서 시행한 복부 전산화단층촬영 검사를 검토한 결과 췌장 미부에 약 3.3 cm 크기의 조영증강을 보이는 중격을 가진 분엽상의 낭성병변이 관찰되었다(Fig. 3). 복부 자기공명영상 검사를 시행하였으며 이 종괴는 조영 전 T1 강조영상에서 등신호강도를 보이고(Fig. 4A), 조영증강 영상에서 내부의 중격만 조영증강 되었다. 또 T2 강조영상에서 이 병변은 높은 신호강도를 보였고(Fig. 4C), T1 강조 조영증강 후 10분 지연영상에서는 중격과 내부 벌집모양의 병변이 조영증강 되는 소견이었다(Fig. 4B). 종괴의 경계는 비교적 분명하고 주변 지방조직으로의 침윤은 관찰되지 않으며 주변의 림프절병증 소견은 보이지 않았다. T2 강조영상에서 낭종이 물과 같은 정도의 높은 신호강도가 아니고 낭종 내 신호강도가 고르지 않다는 점에서 복합성 장액성 낭성종양 또는 낭성 변화를 보이는 신경내분비종양 의심하에 원위부 췌장절제술을 시행하였다.
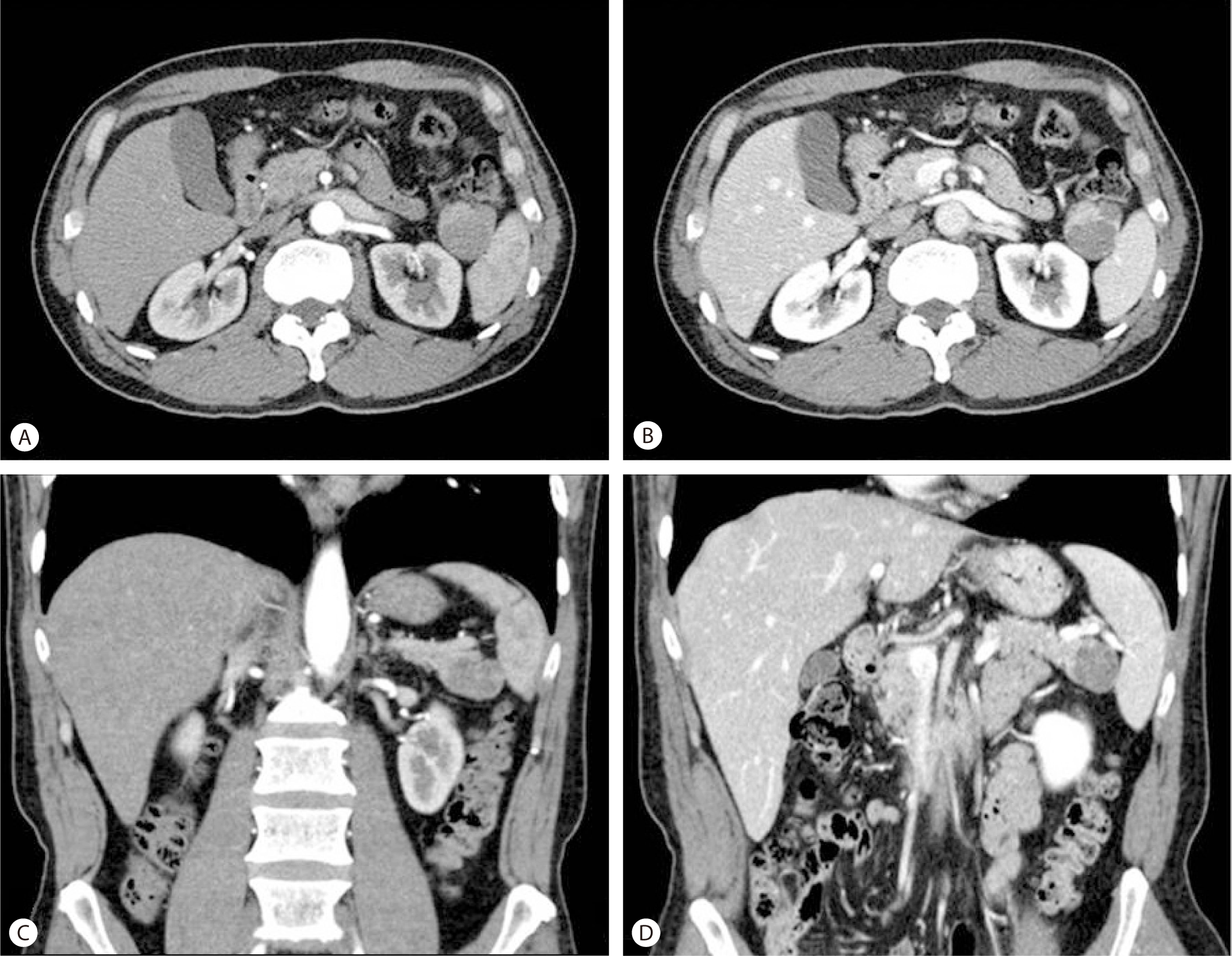
Abdominal computed tomography obtained during arterial (A: axial view, C: coronal view) and portal (B: axial view, D: coronal view) phases demonstrate 3.3 cm sized lobulated cystic mass in pancreas tail. Solid component, which is later revealed to be intrapancreatic accessory spleen, shows same attenuation as spleen in pancreas tail.
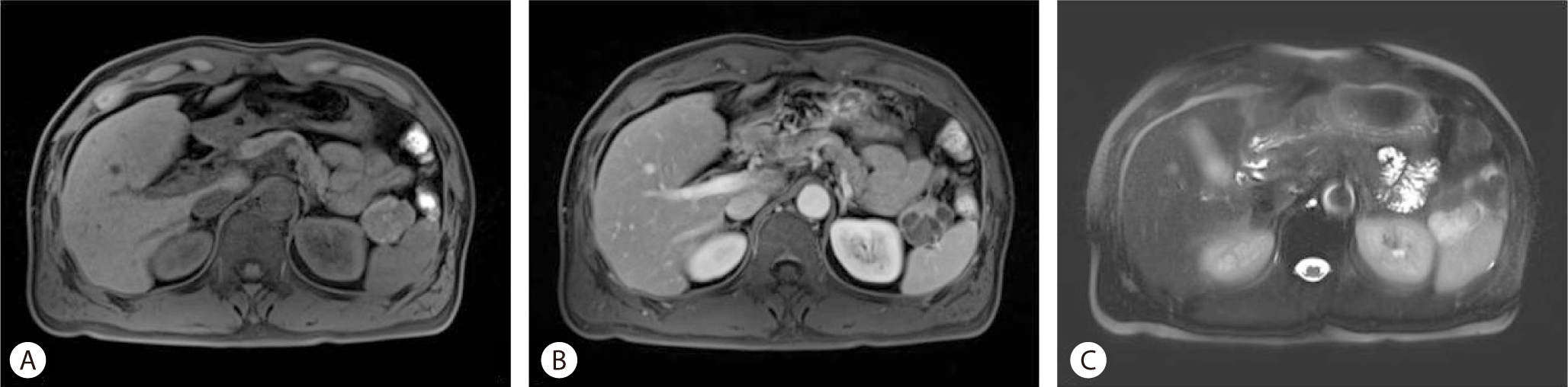
Magnetic resonance imaging shows the cystic mass in the tail of the pancreas with isointensity on precontrast T1-weighted (A) and hyperintensity on T2-weighted (C) images compared to the pancreas parenchyma. The cystic mass shows septal enhancement on contrast-enhanced T1-weighted image (10 minute delayed phase) (B).
수술 후 절제된 조직의 육안 소견은 부드럽고 경계가 잘 지어지는 2.5 × 2.0 × 2.0 cm 크기의 낭종으로 낭종을 절개하였을 때 낭종의 내부에서 장액성 물질이 흘러나왔다. 현미경 소견에서는 편평상피로 구성된 낭종과 주위로 비장조직이 관찰되어 췌장 내 부비장에서 발생한 유표피 낭종으로 진단되었다(Fig. 5).
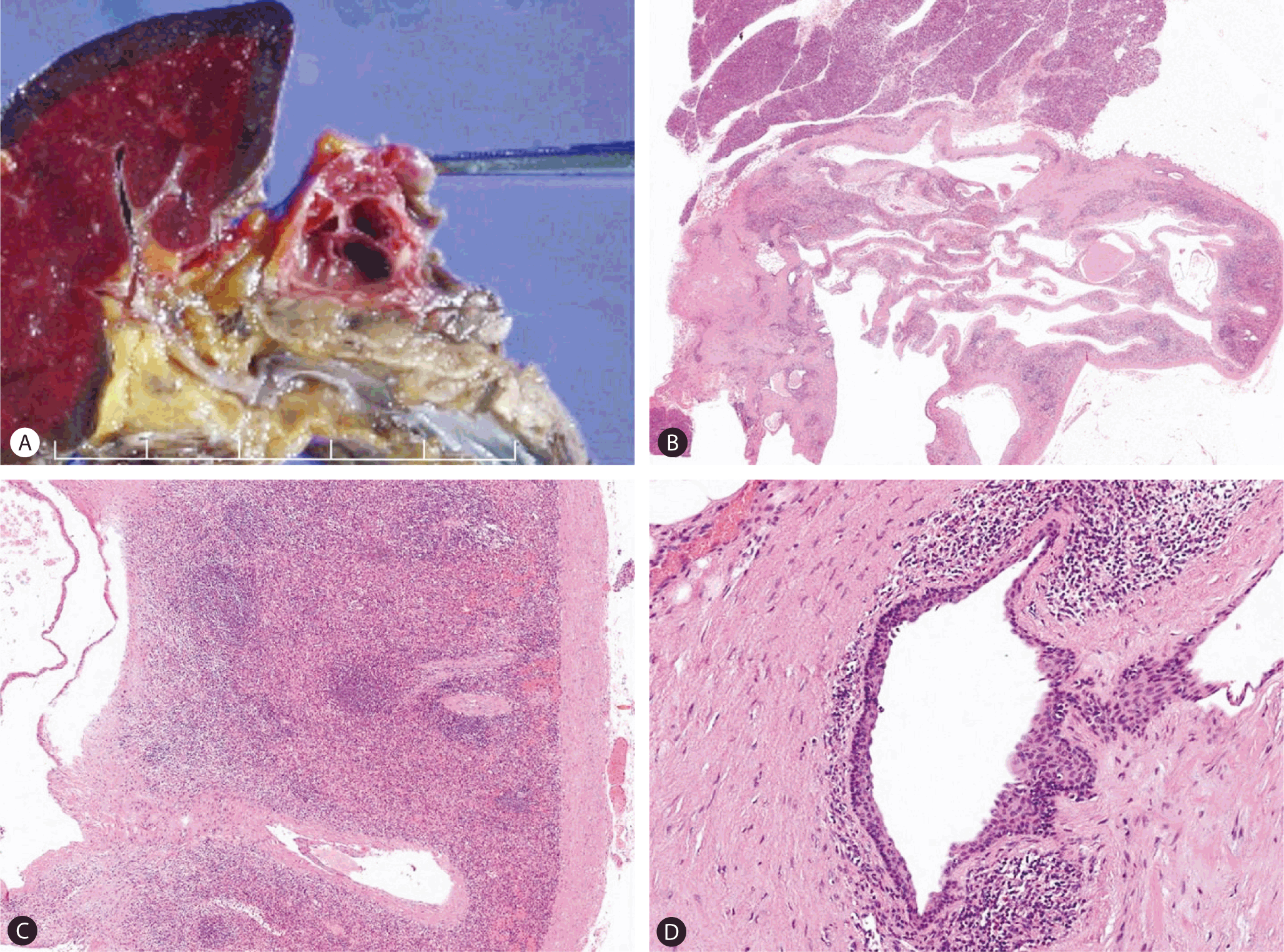
Pathologic features. (A) A reddish multilocular cyst with thin walls is well-demarcated from the surrounding pancreatic parenchyma. Microscopically, (B) the multilocular cyst with intervening splenic tissue is separated from the pancreas by a fibrous capsule (H-E, ×10). (C) Intrapancreatic accessory spleen contains white pulp (H-E, ×100). (D) The cystic lesion lined by squamous epithelium (H-E, ×100).
고 찰
부비장은 전 인구의 약 10-30%에서 관찰되는 것으로 보고되고 있으며 일반적인 영상학적 검사에서 우연히 발견되는 경우도 비교적 흔하다[8]. 부비장은 횡격막부터 골반강 내의 복강 내 어느 위치에도 존재할 수 있으나, 비장문에서 가장 흔히 발견되며 췌장 미부에서 발견되는 경우는 전체에서 약 16.8%로 두 번째로 흔한 위치이다[1,8]. 부비장은 구조적으로 비장과 동일하며, 태아기 5주에 등쪽 위간막(dorsal mesogastrium)에 위치하는 비장 조직의 융합부전으로 발생하거나, 외상이나 비장 절제술 후 비장 조직의 자기 이식에 의해 발생한다[9].
비장은 다른 장기에 비해서 낭성 병변이 관찰되는 경우는 드물며 발생빈도는 약 0.5-2.0%로 알려져 있다[10]. 비장의 낭성 병변은 대부분 양성이고 내벽을 구성하는 상피세포층의 유무로서 진성 혹은 가성낭종으로 분류한다[11]. 가성낭종은 비장의 낭성 병변의 70-80%로 가장 많고 이는 외상 후에 발생하는 경우가 대부분을 차지하고 있다. 또 진성낭종은 기생충 및 비기생충성으로 분류할 수 있고, 비기생충성 낭종에는 혈관종, 림프관종, 유표피 낭종, 유피낭종 등이 있다. 포충낭종(Hydatid Cyst)은 기생충성 낭종 중 하나이다[12].
유표피 낭종은 모발이나 피부 부속기가 없는 다층의 편평상피로 내벽이 구성된 양성 종양이다. 비장의 유표피 낭종은 비장의 진성낭종 중 약 10-20% 빈도를 차지하고, 췌장내 부비장에서의 유표피 낭종은 극히 드물다[10]. 현재까지 약 32개의 증례가 보고되었으며 그 중 15명은 남자, 17명은 여자였고 평균 연령은 약 46세 정도였다[2-4]. 췌장 내 부비장에서 발생한 유표피 낭종은 임상적으로 매우 다양하게 나타나며 검사 소견에 의해 다른 질환과 감별할 수 있는 특징이 없다. 낭종은 단방성 또는 다방성을 보이며 현재까지 보고된 유표피 낭종은 모두 췌장 미부에 위치하였고 본 증례에서도 모두 췌장 미부에 있었다. 그런 이유로 췌장 내 부비장 유표피 낭종의 상피가 췌장관에서 발생한다는 가능성이 제기되어 왔다[13]. 낭종 내벽을 구성하는 세포는 각질화 또는 비각질화 중층편평상피, 입방상피 또는 그 혼합이었다. Higaki 등은 비장 낭종이나 부비장 낭종을 가진 환자에서 수술 전 CA 19-9과 CEA의 상승을 보였고, 수술 후 그 수치가 감소하는 것을 보고하였다[10]. 이전 18증례 중 10증례에서는 수술전 CA 19-9가 상승하였고 나머지 8증례에서는 정상이었다[3]. 본 증례에서는 2명 모두 수술 전 CA 19-9의 경한 상승이 관찰되었다.
지금까지 우리나라에서 췌낭 내 부비장 유표피 낭종은 본 증례를 포함하여 총 7증례가 보고되었다. 그 중 5명은 남자, 2명은 여자였고 연령은 32세에서 56세로 분포하였다(평균: 47세). 보고된 증례 중 증상을 동반한 경우는 4예 였으며 나머지 3예에서는 우연히 발견되었다. 환자가 보고한 증상으로 복통은 3예에서 동반되었고 구역 및 구토가 있었던 경우는 1예였다. 모든 환자에서 CA 19-9 검사를 시행하였으며 그 중 2예에서는 상승소견을 보였고 나머지 5예에서는 정상이었다. 낭종은 모든 증례에서 췌장 미부에 위치하였다. 수술 전 진단으로 1예에서는 췌장 내 부비장에서 발생한 유표피 낭종을 의심하였고 나머지 6예에서는 췌장 내 낭성종양, 췌장암을 의심하여 수술적 절제를 시행하였다[2-4]. 이러한 경향은 국외에서 보고된 췌장 내 부비장에서 발생한 유표피 낭종의 증례와 큰 차이를 보이지 않았다.
췌장과 비장 내 낭성 병변은 방사선학적 영상검사로 진단이 비교적 쉬운 편이나, 췌장 내 부비장에서 발생한 유표피 낭종은 특이적 방사선 소견이 없어 진단하기 매우 어려워 췌장 내 낭성 종양으로 오진되기가 쉽다. 췌장 내 부비장 조직이 상대적으로 많다면, 종괴의 고형 성분이 복부 전산화 단층촬영 검사에서 비장과 비슷한 조영증강을 보이고 자기공명영상 검사에서 비장과 같은 신호 변화를 보인다는 점에서 방사선학적 영상검사로 췌장 내 부비장의 유표피 낭종을 진단 할 수 있다. 하지만 부비장 조직이 많지 않으면 정확한 진단은 매우 힘들며 본 증례에서도 수술 후 절제 조직에서 부비장 조직이 상대적으로 적게 관찰되었으며 이로 인해서 수술 전 영상검사로 정확한 진단은 할 수 없었다. 췌장 내 낭종이 있을 경우 감별진단을 해야 하는 질환으로 가성낭종, 장액성 낭성종양, 점액성 낭성종양, 췌관내 유두상 점액성 종양, 림프 상피 낭종 등이 있으며, 드물게 발생하지만 유표피 낭종도 감별진단으로 고려할 수 있다[14]. 췌장의 장액성 낭성종양은 췌장의 두부, 체부, 미부에 비슷한 빈도로 발생하고 병리학적으로 단층의 입방상피세포로 구성된 소낭성 낭종들이 모여 벌집 형태를 이루고 있다. 점액성 낭성종양은 40-50대 여자에 많고 대부분 체부나 미부에서 발견되며 대낭성 병변으로 두꺼운 섬유벽으로 형성된 단일 낭성 혹은 6개 이하의 다낭성 낭종으로 구성이 된다. 내부에 벽재결절을 포함할 수 있으며 약 10%에서는 낭종벽을 따라서 혹은 내부 격막에 석회화를 동반할 수 있다. 낭종의 내부 표면은 점액을 가지는 원주세포성 상피로 이루어져 있으며 난소 간질이라고 불리는 상피 바로 아래에 세포밀도가 높은 간질층이 있다. 췌관내 유두상 점액성 종양은 60대 이상의 연령에서 췌장 두부에 흔하게 발생하며 15% 환자에서 점액으로 인하여 췌관이 막혀 증상을 보인다. 또 췌관내 유두상 점액성 종양은 주로 췌장 두부에 발생, 췌관 내 유두상 병변이 있고 림프조직 부족하다는 점에서 특징적으로 진단된다. 고형 가유두상 종양은 처음에는 고형종양으로 시작되나 병변이 커지면서 병변 내부가 괴사가 되면서 낭성 변화된 부위가 혼재되는 특징이 있다[15].
췌장 내 부비장뿐만 아니라 췌장의 낭성 종양은 양성 또는 악성을 확인하기 위해 일반적으로 수술적 절제를 고려한다. 췌장의 낭성 종양에서 수술적 절제는 환자의 증상이 있을 때, 흡인한 낭액에서 악성이 의심되거나, 영상의학적으로 점액성 종양이 의심되는 경우, 진단이 불명확할 경우에 권고된다. 부비장에서 발생한 유표피 낭종은 크기가 작거나 무증상일 때 수술적 치료는 필요하지 않으나 실제 임상에서는 수술 전 진단이 어렵고 악성의 가능성을 완전히 배제할 수 없어 대부분 수술적 절제를 하고 있다[5]. 본 증례에서는 영상학적 검사에서 신경내분비 종양이 우선적으로 의심되나 악성의 가능성을 배제할 수 없으며 조직학적인 진단을 위해서 내시경 초음파 유도하 세침흡인 검사를 시도할 경우 췌장 미부에 위치한 종괴에 대해서는 경로를 통한 전이(track seeding) 또는 파종성 전이의 위험이 있을 것으로 판단되어 조직학적 확진 없이 수술적 절제를 시행하였다.
결론적으로 췌장 내 부비장의 유표피 낭종은 극히 드물게 발생하며 영상학적인 검사나 임상양상으로 다른 췌장의 낭성 종양과 구분하기가 어렵다. 따라서 췌장 낭성 종양에 대한 감별진단으로 췌장 내 부비장의 유표피 낭종의 가능성도 고려가 필요하겠다.
Notes
The author has no conflicts to disclose.