내시경유두절제술 후 췌장염 예방을 위한 췌관 배액관 삽입
The Prevention of Pancreatitis after Endoscopic Papillectomy; Stent versus No Stent
Article information
Abstract
내시경유두절제술은 유두부 선암의 치료에 있어 수술적 절제를 대치할 수 있는 비교적 비침습적인 시술로 알려져 있다. 하지만 시술과 관련된 합병증 발생은 무시할 수 없으며, 췌장염은 비교적 흔히 발생하는 합병증이다. 이를 예방하기 위한 췌관 스텐트 삽입이 시도되고 있으며, 다양한 시술 방법을 소개하고 있다. 하지만 내시경유두절제술 후 예방적 췌관 배액관 삽입이 췌장염 예방에 효과적이라는 데는 논란이 있으며, 이와 관련된 대규모 숫자를 포함한 전향적 비교 연구가 필요하며, 이를 통해 위험인자를 규명하는 연구가 필요할 것으로 생각된다.
Trans Abstract
Endoscopic papillectomy (EP) has been considered to be a less invasive, alternative therapy to surgery for ampullary adenoma. However, complication rates after EP could not be ignored, when compared to endoscopic resection for gastrointestinal lesions. Among them, the prevalence of postpapillectomy pancreatitis is higher in EP than ERCP. The prophylactic placement of a pancreatic stent has been reported to decrease the risk of pancreatitis after EP. However, since pancreatic stent placement after EP is not always successful, various novel techniques have been developed to ensure reliable stent placement. Despite the recent advances in EP, a prospective, randomized, controlled study with a larger number of patients is needed to assess the efficacy of pancreatic stent placement to prevent pancreatitis.
서 론
내시경유두절제술(endoscopic papillectomy)은 1983년 처음 문헌으로 보고된 이 후, 과거 문헌에서 내시경 치료의 안전성을 입증하면서 유두부 종양에 대한 최소 침습 치료로 선택된 환자에서 수술적 치료를 대체할 만한 결과를 보이고, 치료 성적도 우수한 것으로 알려져 있다[1-3]. 최근에는 선암과 같은 양성 종양에 대한 일차적 치료법으로 제안되고 있다. 하지만 담도 및 췌관 개구부가 합류되는 십이지장 주유두부를 절제함으로써, 위장관 종양에 대한 내시경 절제술과 비교해서 시술과 관련된 합병증 발생 빈도가 높은 고위험군의 시술이라고 할 수 있다. 이 중 췌장염은 가장 흔한 합병증으로 이에 대한 예방이나 치료에 대한 지침이 필요하며, 췌관 배액관을 삽입함으로써 이를 예방하려는 노력이 있어 왔다. 본 원고에서는 내시경유두절제술에 있어 췌장염 예방을 위한 췌관 스텐트 삽입의 시술 방법과 효용성에 대해 문헌고찰을 통해 알아보고자 한다.
내시경유두절제술과 관련된 합병증
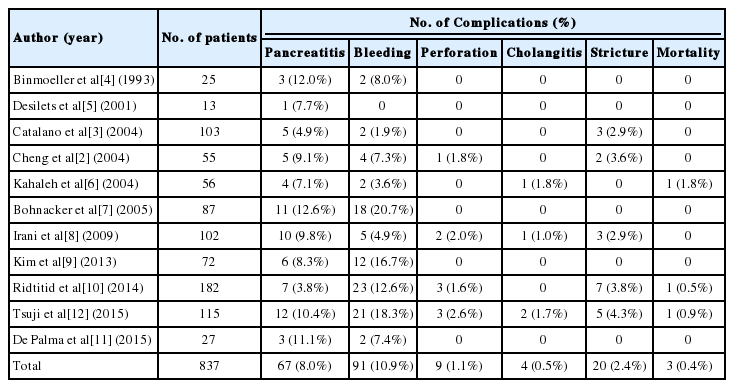
과거 문헌에서 보고된 시술과 관련된 치사율은 0.4%로 내시경유두절제술은 비교적 안전한 시술 방법이나 위장관에서 발생한 선종에 대한 내시경절제술에 비해 합병증 발병은 다소 높다(Table 1) [2-12]. 내시경유두절제술에 의한 합병증은 시술 직후 출혈(10.9%)과 췌장염(8.0%)이 가장 흔하고, 그 외 천공, 담관염이 있으며, 장기적으로는 유두 협착이 문제가 되는 경우가 있다[13]. 시술 중 발생하는 출혈의 경우 내시경 지혈술을 통해 치료가 가능하나, 심각한 출혈인 경우 색전술을 통한 지혈술이 필요할 수도 있다. 보다 심각한 합병인 십이지장 천공은 드물게 발생하지만 큰 선종을 분할 절제시 위험성이 증가하며, 이차적으로 복막염으로 진행할 수 있기 때문에, 시술 도중 천공된 부분이 육안적으로 확인되지 않으나 우측 신장 주변의 후복막 공기 음영이 나타나면 천공으로 진단하고 최대한 내시경을 통한 송기를 적게하고, 클립 등으로 천공을 봉합한 뒤 보존적 요법을 시행하면 대부분 치료가 가능하다[2,14]. 하지만 시술 도중 복막이 보일 정도의 큰 천공이나 영상 검사에서 복막염이 의심되는 경우에는 수술적 치료가 필요하다.
내시경유두절제술 후 췌장염은 보고자에 따라 그 발생률을 다양하게 보고하고 있고 시술과 관련된 치사율은 대부분 췌장염과 관련이 있다[6,10,12]. 췌관과 연결된 부위를 절제하여 발생하는 췌장염의 발생을 예방하고자 일부 시술자에서 췌관 배액관 삽입을 시도하고 있다[3,4,9,14,15]. 하지만 아직까지 췌관 배액관 삽입이 췌장염 발생의 예방에 효과가 있는지에 대해서는 논란의 여지가 있다.
성공적인 췌관 배액관 삽입을 위한 시술 방법
통상적인 내시경유두절제술 방법은 내시경 역행 췌담관조영술(endoscopic retrograde cholangiopancreatography, ERCP)을 통해서 유두부 종괴가 췌관이나 담관 내로 침범이 되지 않았음을 확인 후, 절개올가미를 이용하여 종괴를 충분한 절제 영역을 포함하여 포획한 후 전기 통전을 통해 종괴를 절단하게 된다. 절제 후 췌관 배액관의 삽입은 시술 후 췌관 개구부의 염증성 부종으로 인한 췌관 폐쇄를 막아 췌장염을 예방하고, 췌관 개구부의 협착 위험성을 최소화할 수 있으며, 다른 추가적인 열 소작 등의 안전한 시술을 가능하게 한다. 절제 후 카테터를 이용하여 췌관 개구부를 확인하여, 유도선을 췌관 내로 삽입한 후, 3 Fr 혹은 5 Fr 굵기의 플라스틱 스텐트를 삽입한다. 3 Fr 배액관은 시간이 경과하면서 자연스럽게 췌관을 빠져나올 수 있으나, 대부분에서는 추적 내시경을 통해서 제거하여야만 한다. 종괴가 크거나, 시술시 전기 통전 시간이 오래될 경우 절단면에 부종이 생기거나, 절제시 일부에서 발생하는 출혈로 인해 췌관 입구를 찾는데 어려울 수가 있다. 이 경우 반복적인 췌관 삽관을 시도하려는 과정에서 시술이 성공적으로 이루어지지 못하고, 췌장염을 유발할 수도 있다. 따라서 성공적으로 췌관을 확보하기 위한 시도가 여러 문헌에서 보고하고 있다(Table 2) [5,9,16-21].
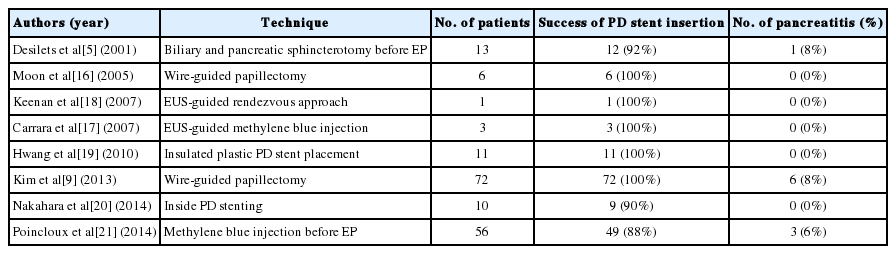
Techniques to facilitate pancreatic intubation for PD stent insertion and their effect of pancreatitis prevention
초기에는 절제 전에 췌관 및 담관괄약근절개술을 시행하여 선종절제 후 췌관 개구부를 쉽게 확인하여 췌관 배액관 삽입을 용이할 수 있으나, Desilets 등[5]의 보고에서는 부분절제(piecemeal resection)가 되어 반복적인 절제술이 필요한 단점을 보고하고 있어 통상적인 시술 방법으로는 권장되지 않는다. 이후 일부 증례 보고로 초음파 내시경을 이용하여 췌관 내에 methylene blue 염색약을 주입하거나, 췌관으로 유도선을 췌관 입구로 노출시켜 배액관을 삽입하는 방법(rendezvous approach)을 보고하고 있으나, 초음파 내시경 시술에 대한 숙련된 경험이 요구되어 보편적으로 시술하는데 어려움이 있다[17,18]. Moon 등[16]은 췌관 내로 유도선을 삽입한 상태에서 유두절제술을 시행한 후 췌관내 삽입된 유도선으로 배액관을 삽입하거나, 2차 유도선을 이용하여 배액관을 삽입하는 방법을 보고하였는데, 72명의 환자 모두에서 성공적으로 췌관 배액관을 삽입하였으며, 이 중 1예(8%)에서 경미한 췌장염이 발생하였음을 보고하였다.
Hwang 등[19]은 PTFE (polytetrafluoroethylene) 재질로 만든 절연 췌관 배액관을 고안하여 유두절제술 전에 췌관 배액관을 삽입한 상태에서 절제술을 시도한 성적을 보고하였다. 비록 적은 수에서 시도하여 췌장염 발생을 예방할 수 있었으나, 절제한 조직을 회수하기 위해 추가적인 절개가 필요한 단점이 있다. 췌관 배액관 삽입 후 절제를 용이하게 하기 위한 방법으로 유도선을 부착한 상태에서 췌관 내로 배액관을 삽입한 후 절개 후 부착된 유도선을 끌어내어 배액관을 십이지장으로 노출시키는 방법을 보고한 경우가 있으며, 이분 췌장을 제외하고 성공적으로 배액관을 삽입하였고, 췌장염은 발생하지 않았다[20].
최근에는 췌관 내로 methylene blue 염색액을 절제 전에 주입한 후, 절제면에서 흘러나오는 염색액을 확인함으로써 용이하게 췌관 배액관을 삽입할 수 있음을 보고하고 있다[21]. 이는 추가적인 기구나 시술이 필요하지 않는 용이한 방법으로 생각되나 비교 연구가 필요할 것으로 생각된다.
지금까지 보고된 시술 방법은 적은 수에서 성공적인 시술을 보고하고 있어, 보편적인 시술 방법으로 인정받기 위해서는 안정성과 편리성에 대한 대규모 수를 포함하는 전향적인 비교 연구가 필요할 것으로 생각된다.
췌관 배액관 삽입 필요성 및 효과
췌장염은 내시경유두절제술 후 흔히 발생하는 합병증으로서 5-15% 정도의 환자에서 발생하는 것으로 보고되었다[13]. 시술 후 발생하는 췌장염은 항상 췌관의 폐쇄로 인해 발생하는 것이 아니고, 절제시 전기 통전으로 인한 화상이나 췌관으로 유도선을 삽입하기 위한 반복적인 자극이 원인이 될 수 있다. 췌장염을 예방하기 위한 췌관 배액관 삽입의 근거는 과거 문헌을 통한 메타분석에서 ERCP 검사시 췌관 배액관 삽입을 하지 않았을 경우, 췌장염 발생의 위험도가 3배 높다는 보고를 근거로 하고 있다[22]. 따라서 유두절제술 후 췌관 배액관의 삽입은 시술 후 췌관 개구부의 염증성 부종으로 인한 췌관 폐쇄를 막아 췌장염을 예방할 뿐만 아니라, 불완전 절제시 추가적인 열 소작과 같은 시술을 안전하게 할 수 있으며, 장기적으로 췌관 개구부의 협착 위험성을 최소화할 수 있는 이점이 있다.
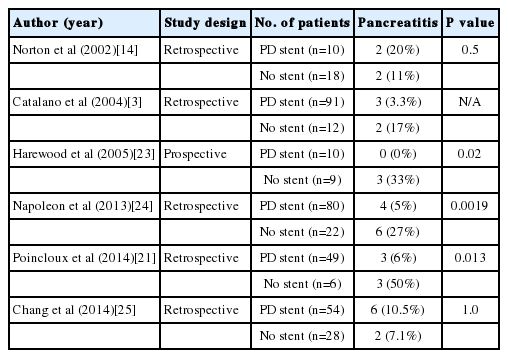
췌관 배액관 삽입의 효용성에 대한 전향적 무작위 대조 연구를 통해서 Harewood 등[23]은 29명의 내시경유두절제술을 시행받은 환자에서 췌관 배액관을 삽입한 19명의 환자에서는 췌장염의 발생이 없었으며, 췌관 배액관을 삽입하지 않은 9명의 환자 중 3명에서 췌장염이 발생하여, 예방적 췌관 배액관 삽입의 유용성을 입증하였다. 하지만 적은 수의 환자를 대상으로 하여, 그 효용성에 대해서는 논란의 여지가 있다. 그 이외에도 후향적 비교 연구들을 분석하였을때, 췌관 배액관 삽입이 췌장염 발생에 통계학적으로 유의한 결과를 보이는 경우도 있었지만, 그렇지 않은 성적도 보고하고 있어 논란이 있다(Table 3) [3,14,21,23-25]. 따라서 모든 시술에서 췌장염 예방 목적으로 췌관 배액관 삽입은 권유되지 않으며, Binmoeller 등[4]은 췌액 배출이 지연되는 경우에만 췌관 배액관 삽입이 필요하다고 하였고, Catalano 등[3]의 연구에서는 내시경유두절제술 후 췌장염은 췌관 배액관을 삽입하지 않았던 군에서 더 흔하게 발생하였다고 보고하여 선택적으로 배액관 삽입을 권고하였다. 하지만 Chang 등[25]의 연구와 같이 췌관 배액관 삽입군과 비삽입군 사이에 췌장염 발생의 차이가 없다는 보고도 있다. 그 후로 대규모 환자를 대상으로 한 비교 연구가 진행되지 않아, 확실한 근거를 제시하지 못하고 있는 실정이다. 또한 최근 Akbar 등[26]의 연구에서 ERCP 후 췌장염을 예방하는데 췌관 배액관보다 직장 nonsteroidal anti-inflammatory drugs가 더 우월하다는 보고가 있어, 이에 관련한 추후 연구가 필요할 것으로 생각된다.
결 론
내시경유두절제술이 처음으로 시행된 후 30년이 지난 지금까지도 췌장염을 예방하기 위한 췌관 배액관 삽입의 필요성에 대해서는 아직까지 논란의 여지가 있다. 대부분의 문헌에서는 췌관 배액관 삽입을 권유하고 있으나, 선택된 경우에 시술을 권유하는게 권유된다. 종양의 크기가 커서 통전하는 시간이 오래 걸린 경우, 잔류 종양이나 출혈로 췌관 입구 근처에서 열소작을 한 경우, 췌관의 배액이 지연되는 경우에는 췌관 배액관을 삽입하는 것이 좋으며[4], 유두절개술 후 절단면을 자세히 관찰하였을 때에 췌관의 입구가 명백히 보이거나 쉽게 췌관의 삽관이 가능한 경우에는 배액관이 필요가 없다[14]. 또한 부췌관(minor papilla)으로 췌장액의 흐름이 적절하거나 이분 췌장(pancreas divisum)인 경우에도 배액관 삽입은 필요하지 않다. 하지만 췌장염 발생과 관련된 위험인자들에 대한 연구를 분석함으로써, 선택적으로 췌관 스텐트 삽입이 필요할 것으로 생각되며 이에 대한 전향적인 연구가 필요할 것으로 생각된다.
Notes
Conflicts of Interest
The author has no conflicts to disclose.