만성 췌장염의 임상상, 자연경과 및 합병증
Clinical Features, Natural History, and Complications of Chronic Pancreatitis
Article information
Abstract
만성 췌장염은 췌장에 꾸준히 진행되는 염증과 섬유화를 특징으로 하는 질환으로 주요 임상특징은 복통, 흡수불량, 영양실조, 당뇨병 및 췌장 석회화이다. 이전에는 급성 췌장염과 만성 췌장염이 분리되어 있는 별개의 질병으로 생각하였으나 현재는 급성 췌장염과 만성 췌장염은 같은 질병의 연속선상에 있는 것으로 여겨지고 있다. 그 근거로는 급성 췌장염과 만성 췌장염의 발병원인이 상당부분 비슷하며 급성 췌장염이 만성 췌장염으로 진행할 수 있기 때문이다. 최근의 연구에 의하면 급성 췌장염의 첫 번째 발생 환자의 10%에서 만성 췌장염이 발생하였고, 재발성 급성 췌장염 환자의 36%에서 만성 췌장염으로 진행하였으며 진행하는 위험인자는 흡연, 음주 그리고 남자 성별이었다.
만성 췌장염의 만성적인 심한 통증은 삶의 질을 떨어뜨리고 사회활동을 제한하는데 주요 기전은 1) 췌관이나 췌실질의 압력증가로 인한 허혈과 2) 말초 및 중추의 통각수용신경의 민감화이다. 만성 췌장염의 통증은 간헐적인 양상과 연속적인 양상이 있으며 연속적인 양상의 통증이 삶의 질을 더 떨어뜨리는 것으로 보고되었다. 만성 췌장염의 복통은 만성 췌장염의 유병기간이 증가하면서 췌장이 "burn out"되어서 통증이 없어진다는 보고도 있지만 유병기간이 길어져도 통증이 남아 있다는 보고도 있어서 추가적인 연구가 필요하다. 지방변은 췌장의 외분비기능이 10% 이하로 남아 있을 때 발생하게 되므로 많이 진행된 만성 췌장염에서 관찰되는데 외분비기능부전은 만성 췌장염 환자의 50-80%에서 나타날 수 있는 것으로 알려져 있다. 만성 췌장염에서 췌장의 내분비 조직의 파괴는 상대적으로 늦게 나타나는 것으로 알려져 있지만 오랜 기간 추적하였을 때 만성 췌장염 환자의 40-80%에서 당뇨병이 발생한다. 만성 췌장염과 연관된 당뇨병은 3c형 당뇨병으로 분류되며 췌장의 폴리펩티드 반응이 없는 것이 특징이다. 만성 췌장염 환자에서 당뇨병을 조기진단하기 위해서 해마다 공복 혈당과 당화혈색소를 측정하도록 권유한다. 가성낭종은 만성 췌장염 환자의 25% 정도에서 발생하며 가장 흔한 증상은 복통이며 가성동맥류와 같은 합병증이 발생할 수 있다. 가성동맥류가 발견이 되면 출혈발생 여부와 관계없이 치료해야 한다. 담관 협착도 만성췌장염 환자의 10% 정도에서 발생하여서 간기능검사 이상, 황달, 담관염을 발생시킬 수 있다.
Trans Abstract
Chronic pancreatitis is a debilitating disease characterized by abdominal pain, exocrine insufficiency, and diabetes mellitus and has had great social, economic, and psychological impacts. Traditional definition of chronic pancreatitis has been based on irreversible histological findings such as self-sustaining chronic inflammation, fibrosis, and eventual destruction of ductal, exocrine, and endocrine tissues. In contrast, the traditional characteristics of acute pancreatitis have been thought as a complete recovery of pancreatic function and morphology during the convalescence period. Acute and chronic pancreatitis have been considered separated disease entities. However, the current idea regarding the natural course of pancreatitis is that acute pancreatitis can progress to the intermediate step of recurrent acute pancreatitis, and finally to chronic pancreatitis. This evolution can be characterized by a sequence of necrotic and fibrotic events, or described by sentinel acute pancreatitis event (SAPE) hypothesis. Therefore, chronic pancreatitis is better defined as a progressive inflammatory and fibrotic disease of the pancreas with clinical features of abdominal pain, malnutrition, diabetes mellitus and imaging features of pancreatic parenchymal/ ductal calcifications. The complications of chronic pancreatitis include pseudocyst, pseudoaneurysm, fistula, biliary stricture, and duodenal stricture. This review describes the progression from acute to chronic pancreatitis, the mechanisms and nature of abdominal pain, steatorrhea, pancreatogenic diabetes mellitus, pseudocyst, pseudoaneurysm, and biliary stricture associated with chronic pancreatitis.
서 론
만성 췌장염은 췌장에 꾸준히 진행되는 염증과 섬유화를 특징으로 하는 질환으로 주요 임상특징은 복통, 흡수불량, 영양실조(malnutrition), 당뇨병 및 췌장 석회화(calcification)이다. 전통적인 만성 췌장염의 정의는 조직병리학적으로 만성의 비가역적 변화가 췌장에 일어난 것이다. 만성 췌장염의 특징적인 병리적인 소견은 만성 염증, 섬유화, 췌관과 췌선방세포(acinar cell) 및 내분비조직의 파괴 등이다. 이러한 형태학적인 정의 이외에 최근 Whitcomb 등은 기계론적(mechanistic)인 만성 췌장염의 정의를 제안하였다[1]. 임상적으로 만성 췌장염은 위에서 기술한 것과 같이 복통, 외분비기능부전(exocrine insufficiency) 및 내분비기능부전(endocrine insufficiency)으로 정의된다. 실제 환자의 진료 시에는 임상양상과 함께 전산화단층촬영이나 자기공명 담췌관조영술과 같은 여러 가지 영상검사에 의해서 진단하는 것이 일반적이다. 통상적인 만성 췌장염은 질병의 진단 20-25년 이후에 거의 50% 정도의 사망률을 가진다고 알려져 있는데 그 원인은 만성 췌장염의 합병증, 알코올중독의 영향 및 동반질환이다[2]. 본고에서는 먼저 췌장염의 진행과정에 대하여 알아보고, 만성 췌장염의 임상증상, 자연경과 및 합병증에 대하여 기술하면서 이들에 대한 최근의 연구들에 대해 소개하고자 한다.
췌장염의 진행과정
급성 췌장염은 전통적으로 회복기간 동안 췌장의 기능과 조직학적 손상이 완전히 회복되는 것으로 정의되며 만성 췌장염은 만성의 비가역적 변화가 췌장에 일어난 것이다[3,4]. 이렇게 전통적인 정의에 따르면 급성 췌장염과 만성 췌장염은 분리되어 있는 별개의 질병으로 생각되어 왔으며 1984년 마르세이유 분류에서 급성 췌장염은 만성 췌장염으로 진행하는 경우는 매우 드물다고 하였다[5]. 그러나 급성 췌장염과 만성 췌장염의 발병원인이 상당 부분 비슷하며 급성 췌장염이 만성 췌장염으로 진행할 수 있는 것이 알려지면서 현재는 급성 췌장염과 만성 췌장염은 같은 질병의 연속선상(continuum)에 있는 것으로 여겨지고 있다[6,7].
급성 췌장염이 만성 췌장염으로 진행하는 기전에 대한 설명으로 첫 번째로는 "괴사-섬유화 가설(necrosis-fibrosis sequence hypothesis)"이 있다. 괴사-섬유화 가설은 반복적인 급성 췌장염의 발생이 췌장조직에 계속적인 손상을 주고 이것이 결국에는 비가역적인 섬유화를 초래한다는 것이다[8]. 이러한 괴사-섬유화 가설은 만성 췌장염의 유병기간에 따른 점진적인 기능저하를 보여주었던 연구들이 근간이며 만성 췌장염의 임상경과를 잠재기(latent stage), 보상기(compensatory stage), 이행기(transitional stage) 및 진행기(advanced stage)로 단계별로 정형화할 수 있다는 장점이 있다[9]. 하지만 일부 만성 췌장염 환자에서는 췌장실질의 괴사가 거의 없는 경우가 있어 이 가설로는 모든 만성 췌장염의 발생기전을 설명할 수 없다. 이러한 경우를 설명하기 위하여 Whitcomb은 "sentinel acute pancreatitis event (SAPE) 가설"을 제시하였다[10]. SAPE 가설에 따르면 한 차례의 중등도 이상의 급성 췌장염이 발생하면 그것이 단핵구를 모집하여서 상주대식세포(resident macrophage)가 되게 된다. 이후 상주대식세포는 전환성장인자-베타(transforming growth factor-beta)를 통하여 췌장의 섬유화에 필수적인 췌장성상세포(pancreatic stellate cell)의 침윤, 분화, 증식을 유발하게 된다는 것이다. 또한 췌장의 섬유화가 진행하기 위해서는 알코올이나 허혈(ischemia) 등에 의한 반복적인 선방세포의 손상 및 시토카인(cytokine) 분비가 필요하다고 하였다[10].
최근의 메타분석 연구는 급성 췌장염에서 만성 췌장염으로의 진행의 빈도와 위험인자에 대하여 14개의 논문(총 8,492명)을 종합하여 분석하였다[7]. 이 메타분석에 따르면 급성 췌장염이 첫 번째 발생한 후 22%에서 재발성 급성 췌장염이 발생하였고, 만성 췌장염은 급성 췌장염의 첫 번째 발생 환자의 10%에서 발생하였다. 또한 재발성 급성 췌장염 환자의 36%에서는 만성 췌장염으로 진행하였다. 이렇게 만성 췌장염으로 진행하는 위험인자는 흡연, 음주 그리고 남자 성별이었다[7].
임상상과 자연경과
만성 췌장염의 주요 임상특징은 복통, 지방변증(steatorrhea) 및 당뇨병이며 췌장의 석회화는 중요한 진단적 가치를 지닌다. 만성 췌장염에서 발생할 수 있는 주요 합병증은 가성낭종, 가성동맥류에 의한 출혈 및 담관폐쇄 등이다. 복통, 췌장의 석회화, 당뇨 및 외분비기능부전의 자연경과는 만성췌장염의 원인(알코올성, 조기 특발성, 후기 특발성)에 따라 다를 수 있다는 보고가 있다.
1. 복통
대부분의 만성 췌장염 환자는 복통을 호소하는데 복통이 심한 환자는 식욕이 감소되어 적정량의 음식을 섭취할 수 없어 체중감소와 영양실조가 발생하게 된다. 또한 만성 췌장염의 심한 통증은 삶의 질을 떨어뜨리고 사회활동을 제한하며, 환자가 마약성 진통제에 중독될 위험성도 있다. 이러한 심한 만성 통증은 환자의 입원율을 증가시키는데 약물치료나 국소치료에 효과를 보이지 않으면 수술적 치료가 필요할 수도 있다.
1) 복통의 발생기전
만성 췌장염에서 복통의 주요 기전은 2가지로 설명하고 있는데 그 첫 번째는 췌관이나 췌실질의 압력증가로 인한 허혈이다. 이러한 압력증가는 만성 췌장염에서 췌관의 협착이나 췌석으로 인한 췌관의 폐쇄와 연관이 있으며 췌장조직의 허혈을 유발하여 만성 통증을 일으킬 수 있다. 압력의 증가와 관련된 연구로는 만성 통증의 치료를 위하여 수술을 시행하였던 만성 췌장염 환자에서 췌관 및 췌장실질의 압력이 상승되어 있었다는 보고들이 있다[11,12]. 두 번째 기전은 말초 및 중추의 통각수용신경(noceceptive nerves)의 손상 및 변경(alteration)이다. 이것은 만성 췌장염의 허혈, 염증, 압력 등이 통각수용신경의 손상을 일으켜서 말초 및 중추신경을 민감화(peripheral and central sensitization)시켜서 같은 자극이라도 통증을 더 심하게 느끼는 통각과민(hyperalgesia) 상태가 되며, 더 나아가서는 정상적인 생리적 자극에 대해서도 통증을 느끼게 되는 무해자극통증(allodynia)을 느낀다는 것이다. 이러한 중추신경계의 민감화는 지속적일 수 있어서 일부 환자에서 췌장절제를 하여도 통증의 해소가 되지 않는 것을 설명해 주는 중요한 가설이 된다. 이러한 주요 기전 이외에도 만성 췌장염에서 갑자기 복통이 심해지는 경우는 가성낭종, 담도폐쇄, 십이지장 폐쇄 및 췌장암과 같은 합병증의 발생도 고려하여야 한다.
최근 중추 신경의 통각수용변경에 대한 연구로 Dimcevski 등13은 12명의 건강한 대조군과 10명의 만성 췌장염 환자에게 식도, 위, 십이지장에 전기적 자극을 주고 뇌파도(electroencephalogram)를 얻어서 만성 췌장염 환자에서 통각수용계의 대뇌피질 투사(projection)에 변화가 있음을 보여주었다. 또한 식도, 위, 십이지장에 전기적 자극을 주었을 때 보이는 연관통(referred pain)의 범위가 만성 췌장염 환자에서 더 광범위함을 그림으로 잘 나타내서 보여주었다.13 이 외에도 최근 중추신경계의 통각수용변경에 대해서 여러 가지 영상을 이용하여서 대뇌의 변화를 보여준 연구들과 신경병증 통증에 사용하는 pregabalin을 이용하여 치료적 효과를 확인한 연구가 있다.14-16 또한 만성 췌장염의 통증에 대한 이해를 위해서 최근 발표된 종설이 다양한 가설에 대해 설명하고 최근의 연구에 대해 정리해 주어서 참고할 만하다.[17
2) 복통의 양상 및 자연경과
복통의 양상만으로 만성 췌장염을 진단할 수 있는 명확한 범주의 특징적인 복통은 알려져 있지 않다. 복통의 위치는 대개 상복부이며 등쪽으로 방사되는 경우가 많다. 복통의 양상은 깊은 곳을 파는 듯한 양상이라고도 하며 오심과 구토를 동반할 수 있다. 복통은 앞으로 구부리면 호전되는 양상이며 또는 무릎을 가슴에 붙이면서 앉으면 편해진다. 복통은 식후에 악화될 수 있으며 밤에도 종종 나타난다. 만성 췌장염 환자에서 복통의 자연경과는 다양하며 예측하기 힘들지만 많은 환자에서는 만성 췌장염의 초기에는 복통의 에피소드가 있고 일정기간의 휴지기를 가진다. 이러한 급성 복통의 에피소드들이 자주 발생하다가 통증은 점점 연속적이 되며 만성 췌장염의 진단을 받게 된다[18]. 통증이 발생한 뒤에 시간이 지남에 따라서 통증의 양상, 정도 및 시기는 계속 변화할 수도 있다. 연속적이 된 통증은 췌장실질의 석회화, 외분비기능부전 및 내분비기능부전의 발생과 함께 감소한다는 보고도 있는데 이것은 만성적인 자극에 의하여 췌장이 “burn out”되었다고 설명할 수 있다[19]. 반면 Lankisch 등[20]은 만성 췌장염 환자를 10년 이상 추적하였을 때도 절반의 환자에서 여전히 통증이 있어서 burn out 개념을 반대한다고 하여 향후 여기에 대한 연구가 좀 더 필요할 것으로 생각된다.
Ammann과 Muellhaupt [18]은 알코올성 만성 췌장염의 통증의 자연경과를 알아보기 위하여 207명의 환자를 포함하는 전향적 코호트 연구를 시행하였다. 이 연구는 복통을 2가지 타입으로 구분하였는데 A형은 짧고 재발하는(short episodes/relapsing) 통증으로 흔히 급성 재발성 췌장염 단계에서 보여지며 통증의 지속은 10일 미만이며 이후 수개월 이상의 휴지기를 가지게 된다. 이러한 환자들에게 발생한 통증은 진통제로 조절하게 되며 심한 경우 입원해서 치료하게 되는데 대부분 한 차례 이상의 입원이 필요하였다. B형은 연속적이고 지속되는(constant/prolonged episodes) 통증으로 종일 지속되며 중간중간 악화되면 입원치료를 하게 된다. B형 만성 통증은 가성낭종과 같은 국소합병증과 연관이 많았고 수술이 필요한 경우가 A형보다 유의하게 많았다. 이 연구에서는 만성 췌장염의 복통은 평균 11년 정도 뒤에 대부분 소실되어서 burn-out 개념을 지지하였다[18].
최근 Mullady 등[21]은 북미 만성 췌장염 환자의 통증양상, 통증관련 합병증 및 삶의 질에 대한 전향적 코호트 연구를 발표하였다. 이 연구를 위하여 20개의 삼차 병원에서 540명의 만성 췌장염 환자를 모집하였는데 만성 췌장염은 영상검사 또는 조직학적 정의로 진단하였다. 이 연구는 복통을 양상(pattern; intermittent vs. chronic)과 중증도(severity; mild to moderate vs. severe)에 따라서 5가지 형태로 나누었다(Table 1). 이 연구의 540명의 환자 중 77%에서는 자기의 통증을 스스로 형태에 따라 분류할 수 있었는데 A (episodes of mild to moderate pain, usually controlled by medication), B (constant mild to moderate pain, usually controlled by medication), C (usually pain free with episodes of severe pain), D (constant mild pain plus episodes of severe pain), E (constant severe pain that does not change)형은 각각 14.0%, 9.2%, 30.9%, 38.2%, 7.7%였다[21]. 이 연구에서 B형, D형 및 E형은 연속적인 양상(Ammann의 B형)의 통증이므로 전체 환자의 55%는 연속적인 통증이며, 나머지 45%는 A형과 C형, 즉 간헐적인 양상(Ammann의 A형)의 통증을 호소하여서 Ammann의 통증분류가 유효함을 보여주었다. 연속적인 통증을 보이는 환자군에서 간헐적인 통증군보다 장애, 입원, 진통제 사용이 많았고 삶의 질은 낮았다. 그러나 중증도에 따라서 환자군을 나누었을 때는 이러한 장애, 입원, 진통제 사용 및 삶의 질과 연관성이 없어서 만성 췌장염의 복통의 형태에서 중요한 것은 개인이 느끼는 중증도보다는 통증이 연속적인지 간헐적인지가 임상적으로 중요하다고 제시하였다. 이 연구에서는 만성 췌장염의 유병기간은 통증의 양상(p = 0.725)과 중증도(p = 0.142)와 상관이 없었는데 이러한 결과는 Zurich 그룹의 burn out 개념[18,19]에 반대되는 결과이다. Mullady 등[21]의 연구의 후속연구로 Wilcox 등[22]은 518명의 환자를 분석하여 2015년 만성 췌장염의 통증양상과 중증도에 대하여 발표하였다. 이 후속연구에서 통증의 형태는 Mullady 등[21]의 연구와 비슷하게 가장 많은 45%의 환자에서 경도의 통증이 연속되고 때때로 심한 통증이 있는 D형 통증이 있다고 보고하였으며 15.6%의 환자에서는 통증이 없었다고 보고하였다[22]. 이 후속연구에서도 만성 췌장염의 복통의 양상이나 중증도는 복부영상에서 발견되는 구조적 변화와 관련이 없어서 burn-out 개념을 반대하였다. 반면에 Zurich 그룹은 비교적 최근인 2005년의 연구에서도 진행된 만성 췌장염 환자는 원인이나 수술 여부에 관계없이 통증의 소실이 일어난다고 여전히 보고하였다[23].
최근 네덜란드의 연구자들(Dutch Pancreatitis Study Group)은 전향적 코호트 연구를 위하여 2010년부터 1,218명의 만성 췌장염 환자들을 모집하였음을 보고하였다[24]. 이 코호트는 재발성 췌장염, 준확진 만성 췌장염(probable chronic pancreatitis), 확진 만성 췌장염(definite chronic pancreatitis)환자들이 포함되었는데 매년 설문조사로 환자의 통증 및 삶의 질을 평가하게 된다. 지난 2년간 설문조사 반응률이 80%정도로 매우 높았고 향후 결과가 기대된다[24,25].
2. 지방변증
지방변은 췌장의 외분비(exocrine)기능이 10% 이하로 남아 있을 때 발생하게 되므로 지방변의 발생은 많이 진행된 만성 췌장염을 의미한다. 그러나 때로는 췌석이나 협착 등에 의하여 췌관이 막힌 경우에도 지방변이 나타날 수도 있다. 지방변이 발생할 정도의 외분비기능부전 시에도 심각한 체중감소가 발생하는 경우는 드문데 이것은 환자가 보상적으로 영양섭취량을 늘리게 되고 위의 리파제(gastric lipase)가 부분적으로 보상작용을 해주기 때문으로 생각된다. 그러므로 안정되어 있는 만성 췌장염 환자에서 갑자기 심각한 체중감소가 발생한다면 췌장이나 췌장 외의 악성 종양의 발생 가능성을 먼저 생각해 봐야 한다. 오랜 기간 추적하였을 때 췌장의 외분비기능부전은 만성 췌장염 환자의 50-80%에서 나타나며 외분비기능부전까지 걸리는 시간은 발병 후 10-20년 정도로 알려져 있다[19,20,26] 이전의 연구에 따르면 췌장 외분비 기능부전은 알코올성 췌장염에서 13.1년, 조기 특발성 췌장염에서 26.3년 그리고 후기 특발성 췌장염에서 16.9년 뒤에 발생한다고 보고하였다[26].
3. 당뇨병
만성 췌장염에서 췌장의 섬세포(islet cell)는 상대적으로 파괴가 덜 되는 것으로 알려져 있지만 만성 췌장염 환자에서 결국은 내분비기능부전이 나타나게 되며 이것은 특히 췌장의 절제술 후나 열대 췌장염(tropical pancreatitis) 시에 흔하게 나타난다. 만성 췌장염 환자를 오랜 기간 추적하였을 때는 최종적으로 40-80% 정도에서 당뇨병이 발생한다고 알려져 있다[26,27]. 이전의 한 연구는 당뇨병은 알코올성 췌장염에서 19.8년, 조기 특발성 췌장염에서 26.3년, 후기 특발성 췌장염에서 11.9년 뒤에 발생한다고 보고하였다[26]. 다른 연구들에서는 조금 더 짧은 만성 췌장염 발병 후 6-10년 뒤에 당뇨병이 발생함을 보고하기도 하였다[19,28]. 한 연구에 따르면 만성 췌장염 환자에서 당뇨병 발생의 위험인자는 췌장의 석회화와 췌미부절제술인데 이것은 췌장의 섬세포가 췌장의 체부와 미부에 모여 있는 것으로 설명된다[29].
만성 췌장염과 연관해서 발생하는 당뇨병은 미국 당뇨병 학회의 현재 기준에 따르면 III. Other specific types의 C.Diseases of exocrine pancreas로서 해당되어서 3c형 당뇨병으로 정의된다[30,31]. 이 형태의 당뇨병은 서양 당뇨병 환자의 5-10%를 차지한다고 보고되었다[27]. 이러한 만성 췌장염 환자의 당뇨병은 외분비기능부전, 영양실조와 당뇨병이 같이 있는 상태로 치료연관 저혈당이 흔히 발생하는 것으로 알려져 있다. 최근의 전문가 합의보고에 따르면 만성 췌장염 환자의 3c형 당뇨병은 췌장 폴리펩티드 반응(pancreatic polypeptide response)이 없는 것이 1형, 2형과 구분되는 특징이라고 하였고, 만성 췌장염 환자에서 당뇨병을 조기진단하기 위해서 해마다 공복혈당과 당화혈색소(HbA1c)를 측정하도록 권유하였다[31]. 또한 미국의 National Institute of Diabetes and Digestive and Kidney Disease와 National Cancer Institute의 공동 워크샵 보고에서는 3c형 당뇨병의 치료를 위해서는 당뇨약제 투약 이외에도 인크레틴(incretin) 분비의 촉진과 영양상태 개선을 일으키는 췌장효소제 투약이 필요하다고 하였다[32].
4. 췌장 석회화
췌장 석회화는 만성 췌장염의 가장 특징적인 소견으로 한국, 일본, 유럽, 미국의 만성 췌장염의 진단기준에 있어서 매우 중요하다(Fig. 1) [33,34]. 만성 췌장염 환자의 증상 시작단계에서는 췌장 석회화가 0-4% 정도에서 관찰되지만, 8-25년이 지나면 37-59% 정도이고, 14-36년이 지나면 80-91% 정도에서 관찰된다고 알려져 있다[23,26]. 만성 췌장염 환자에서 석회화의 진행속도는 흡연, 음주습관 및 유전적 요인과 연관되어 있는 것으로 알려져 있다[23,35-38]. 최근의 국내연구로는 Lee 등[39]이 59명의 만성 췌장염 환자를 후향적으로 분석하였는데 초기의 전산화단층촬영에서는 췌장의 석회화가 59.3%에서 관찰되었지만 평균 51.6개월 뒤의 추적검사에서는 88.1%의 환자에서 관찰되어서 환자 수가 증가하였고 석회화의 정도도 심해졌는데 이런 석회화의 진행은 흡연의 지속 및 흡연의 정도와 연관되었다고 보고하였다.

Abdominal computed tomography findings of a 49 year-old male with alcoholic chronic pancreatitis. Pancreatic ductal calcification (A, circle) and parenchymal calcifications (B) are seen.
췌장 석회화가 만성 췌장염의 특징이기는 하지만 췌장 석회화가 관찰되었을 때 만성 췌장염 이외에도 낭성종양의 석회화, 담석, 비장동맥 석회화 등과의 감별이 필요하다. Campisi 등[40]은 췌장 전산화단층촬영을 시행한 790명의 환자를 분석하여 13.0%에서 췌장 석회화가 있었는데 이 중 68%만 만성 췌장염이고 13.6%는 신경내분비종양, 4.8%는 췌관내유두상점액종양, 5.8%는 악성 췌관내유두상점액종양, 3.9%는 장액성 낭종 그리고 3.9%는 췌장 선암과 연관된 석회화였다고 보고하였다. 이 연구는 췌장 석회화의 만성 췌장염의 진단을 위한 특이도가 췌장실질에만 있는 경우는 67%, 췌관에만 있는 경우는 88%, 미만성으로 실질에 있는 경우는 91%였고 췌관과 실질 내에 석회화가 있는 경우 특이도가 100%였다고 보고하였다[40]
5. 가성낭종 및 가성동맥류
가성낭종은 만성 췌장염 환자의 25%에서 발생하며 주로 알코올성 만성 췌장염 환자에서 발견된다(Fig. 2) [19,20,26,41,42]. 가성낭종의 가장 흔한 증상은 복통이며 경과 중에 20-40%에서 합병증이 발생할 수 있는데 발생할 수 있는 합병증으로는 혈관압박, 위장관 압박, 감염, 출혈 및 누공(fistula)형성이다. 만성 췌장염에 동반된 가성낭종의 치료의 적응증은 아주 큰 가성낭종, 커지는 가성낭종, 증상이 있거나 합병증이 발생한 가성낭종 등이다. 급성 췌장염에서 발생하는 가성낭종과는 달리 만성 췌장염의 가성낭종은 발견 당시에 성숙이 되어서 캡슐이 형성되어 있는 경우가 대부분이므로 치료가 필요하다면 치료를 연기할 필요가 없다. 2016년 북미의 보고에 의하면 521명의 만성 췌장염 환자 중 167명(32%)에서 가성낭종이 있었는데 남성에서는 37%, 여성에서는 26%로 성별 간에 차이(p < 0.05)가 있었음을 보고하였다[43]. 또 다른 최근의 북미의 보고에 따르면 1,159명의 만성 췌장염 환자 중 344명(29.7%)에서 가성낭종이 있었는데 알코올성 만성 췌장염 환자에서는 39.9% (228/572), 다른 원인의 만성 췌장염 환자에서는 19.8% (116/587)의 환자에서 가성낭종이 있었다[44].

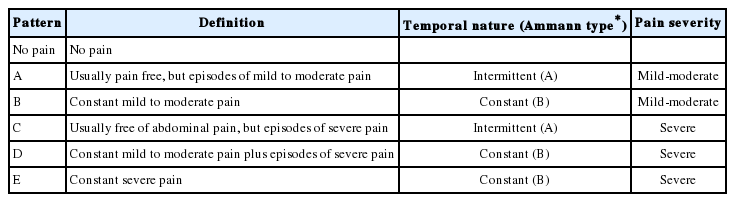
Abdominal computed tomography findings of a 57 year-old male with alcoholic chronic pancreatitis. Pancreatic duct stone (arrow) with upstream dilatation (A) and pseudocyst (B) are noted.
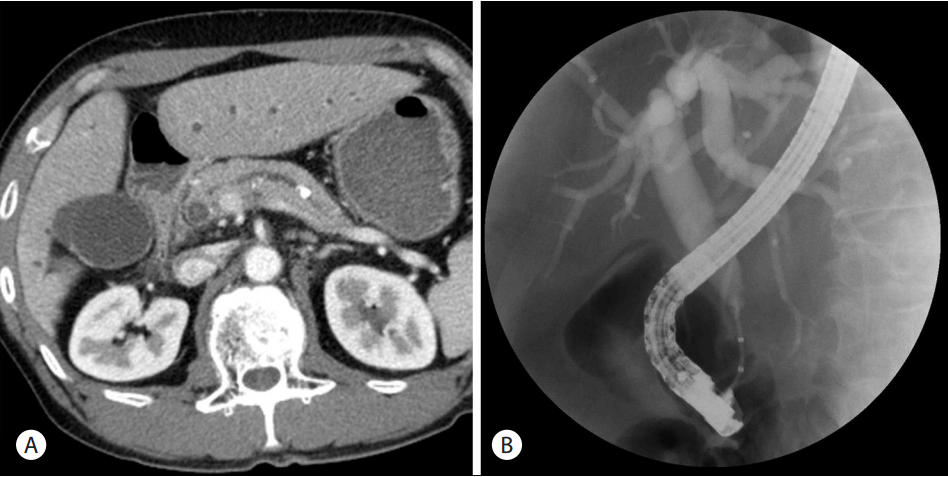
가성동맥류는 동맥의 근육층이 가성낭종의 압력 및 췌장효소에 의한 작용에 의해서 형성되는데 만성 췌장염 환자에서 혈관조영술을 시행하였을 때 21% 정도에서 발견되며 가성동맥류에 의한 출혈은 만성 췌장염과 동반된 가성낭종이 있는 환자의 5-10% 정도에서 발생하는 것으로 보고되었다[45,46]. 가성동맥류에 의한 출혈은 간헐적으로 서서히 일어날수도 있고 급하고 심각하게 일어날 수도 있다. 가성동맥류가 발견이 되면 출혈발생 여부와 관계없이 치료해야 한다(Fig. 3). 최근의 보고에 의하면 34명의 급성(13명)이나 만성(21명) 췌장염 연관 가성동맥류에 대하여 색전술을 시행한 환자에서 평균 6.6년 추적하였을 때 4명(11.8%)의 환자에서 재발하였다[47]. 4명의 재발 환자 중 3명에서는 추적 중에 다른 혈관에 새로운 가성동맥류가 발생하였으며 1명에서는 색전술을 시행한 가성동맥류가 재개된 경우였는데 이러한 재발은 모두 색전술 후 5개월 이내에 발생하였다[46].
Serial imaging findings of 53 year-old male with alcoholic recurrent pancreatitis. Abdominal computed tomography showed ruptured pseudoaneurysm (A). Emergency angiography demonstrated pseudoaneurysm of the splenic artery (B). After embolization with coils and glue (C), no contrast leakage is seen (D).
6. 담도협착
원위부 담도는 췌두부의 후방에서 췌장실질에 둘러싸여 있기 때문에 만성 췌장염에 의해 췌두부에 염증성 및 섬유성 변화가 발생하였을 때 압박될 수 있다. 그 외에 흔히 췌장내 담도를 압박하는 질환은 췌장의 악성 종양이나 가성낭종이다. 췌장에 의한 담도협착이 발생하면 간기능검사 이상, 황달, 담도성 통증이나 담관염이 발생할 수 있다(Fig. 4). 증상이 있는 담도협착은 만성 췌장염 환자의 10% 정도에서 발생할 수 있는 것으로 알려져 있다[48]. 최근의 연구에 의하면 1,159명의 만성 췌장염 환자에서 총담관 확장은 16% (186명)에서 관찰되었으며 12.5% (145명)에서 내시경적 담관 스텐트 삽입이 필요하였고[44], 다른 연구에서도 521명의 만성 췌장염 환자 중 17.9% (93명)에서 총담관 확장이 있고 11.7%(61명)에서 총담관협착이 있어서 11.5% (60명)에서 내시경적 담관 스텐트 삽입이 필요하였다고 보고하였다[43].
결 론
만성 췌장염은 간헐적이거나 연속적인 심한 복통을 특징으로 하는데 만성 췌장염이 진행되면 췌장 외분비기능장애 및 췌장 내분비기능장애까지 초래되어 삶의 질을 매우 떨어뜨리는 만성 염증 및 섬유화 질환이다. 또한 만성 췌장염은 추적하는 동안 가성낭종, 가성동맥류 및 담도협착과 같은 합병증을 드물지 않게 보인다. 그러므로 임상의사는 만성 췌장염의 복통의 자연경과, 유발원인, 외분비기능장애 및 내분비기능장애의 발생에 대하여 명확히 알고 환자를 정기적으로 추적하여야 한다. 임상증상의 자연경과에 대한 연구는 많지 않았지만 현재 진행되고 있는 연구나 향후의 연구들이 만성 췌장염 환자의 관리에 대한 제안을 할 수 있을 것으로 기대된다. 그리고 최근의 연구들은 만성 췌장염이 급성 췌장염과 구분되는 별개의 질환이 아니고 진행되는 질환임을 보여주기 때문에 향후 급성 췌장염에서 만성 췌장염의 진행을 막을 수 있는 방법들에 대한 연구가 결실을 맺어서 췌장염 환자들에게 많은 도움이 될 수 있기를 기대한다.
Notes
Conflict of Interest
The author has no conflicts to disclose.