원발성 유두 장액성 복막암종으로 오인된 급성 췌장염의 합병증
Complications of Acute Pancreatitis Misdiagnosed as Primary Serous Papillary Carcinoma
Article information
Abstract
급성 췌장염은 췌장의 염증성 질환으로 췌장성 복수 및 가성 낭종과 같은 합병증을 일으킬 수 있다. 이러한 합병증은 심할 경우 결장, 복막 및 장간막의 이차성 변화를 일으켜 복막암종과 구별하기 어려울 수 있다. 본 증례의 환자는 타 병원에서 급성 췌장염 및 합병증으로 발생한 가성 낭종을 치료하는 도중 복막암의 가능성이 있어 추가 평가를 위하여 본원으로 전원되었다. 복막암의 가능성을 배제하기 위한 복막 조직검사 없이 순차적인 시술적 접근을 통하여 췌관의 손상으로 발생한 췌장성 복수와 가성 낭종으로 진단할 수 있었다.
Trans Abstract
Acute pancreatitis is an inflammatory disease of pancreas which could lead to a number of complications including pancreatic ascites and pseudocysts. When these complications are severe, the secondary changes in colon, peritoneum or mesentery can make it difficult to distinguish from peritoneal carcinomas. Herein, we report a case of acute pancreatitis that was difficult to differentiate from peritoneal carcinoma. We performed a sequential procedure without peritoneal biopsy to exclude the possibility of peritoneal cancer, and we could diagnose pancreatic ascites and pseudocyst resulting from pancreatic injuries.
서 론
급성 췌장염은 다양한 원인에 의해 발생되는 췌장의 염증성 질환으로 췌장성 복수, 가성 낭종 등의 국소 합병증뿐만 아니라 심한 경우 장기부전을 유발하기도 한다[1]. 이 중 췌장성 복수는 주로 주 췌관의 파열로 인해 발생하고 때로는 가성 낭종의 유출에 의해 발생하기도 한다[2]. 이러한 부작용이 심할 경우 대장, 복막, 장간막 등에 이차적 변화를 일으켜 복막의 암종과의 구별이 어려울 수도 있다.
본 증례는 급성 췌장염으로 타 병원에 입원하여 치료받던 중 복막암종의 가능성이 고려되어 추가적인 평가를 위하여 본원으로 전원되었던 환자로, 체중감량의 목적으로 운동을 하거나 식이조절을 하지 않았음에도 불구하고 만성적인 근육손실과 체중감소가 동반되어 있었다. 또한 CA 125의 상승이 확인되었으며, 복부 전산화단층촬영에서 원발성 유두 장액성 복막암종의 가능성을 감별진단을 해야 한다는 소견이었다. 본원에서 시행된 추가 검사를 통하여 췌장염으로 췌관의 일부가 파괴되었고 이로 인해 췌장성 복수 및 임상증상이 더욱 심해져 종양으로 오인되었다고 판단할 수 있었다. 이에 급성 췌장염의 합병증이 복막암종의 양상을 나타낸 증례를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
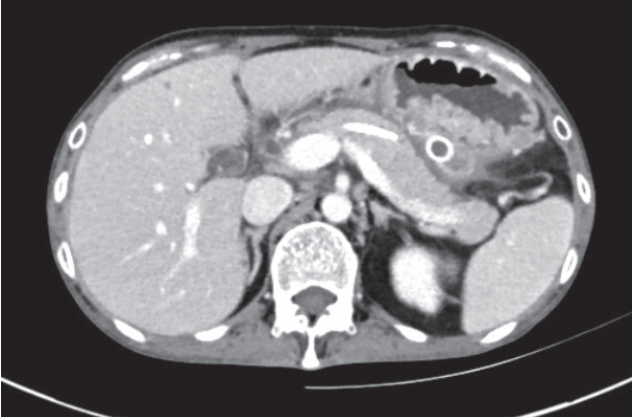
39세의 여자 환자가 복부 전산화단층촬영 검사에서 원발성 유두 장액성 복막암종(primary peritoneal serous papillary carcinoma, PSPC)이 의심된다는 소견으로 타 병원을 통해 본원으로 전원되었다. 타 병원 복부 전산화단층촬영 검사에서 복막의 침윤과 비후, 복수, 장막결절 등의 소견들이 관찰되었다(Fig. 1). 환자는 내원 1년 전부터 금연 상태였으나 이전에는 10년간 하루 반 갑의 흡연력이 있었다. 음주력은 10년간 주당 소주3병 이상이었으며 본원 내원 3달 전 급성 췌장염으로 타 병원에 입원하여 치료받고 퇴원한 과거력이 있었다. 당시에는 영상의학적 검사에서 소량의 복수가 관찰되었으나, 본원 내원 직전에 촬영한 복부 전산화단층촬영에서는 다량의 복수가 관찰되었으며 혈청 CA 125가 81.42 U/mL (0–35)로 상승된 소견이었다. 환자는 본원 내원 당시 복부 팽만감과 복부 전반의 경한 통증을 호소하였으며 3달간 5 kg 가량의 체중 감소가 있었다. 마지막 월경은 본원 내원 두 달 전으로 폐경 상태는 아니었고 오심, 구토 등의 증상은 없었다. 이전 복부 및 골반의 수술력은 없었으며 당뇨, 고혈압, 간염, 결핵 등의 과거력도 없었다. 신체검진 소견에서 결막은 창백하지 않았고 공막의 황달은 관찰되지 않았다. 복부 진찰에서 장음은 감소되어 있었고 복부팽만이 심한 상태로 타진시 이동탁음이 있었다. 입원 당시 혈액 검사에서 총 빌리루빈 0.69 mg/dL (0.2–1.2), 아스파테이트 아미노전이효소(aspartate aminotransferase, AST) 15 IU/L (5-40), 알라닌 아미노전이효소(alanine amino-transferase, ALT) 10 IU/L (3–40), 혈청 총 단백질 6.0 g/dL (6–8), 혈청 알부민 3.3 g/dL (3.5–5.0)로 측정되었다. 혈액요소질소(blood urea nitrogen, BUN) 5 mg/dL (5–23)와 혈청 크레아티닌은 0.33 mg/dL (0.60–1.10)로 정상범위로 나타났으나 혈청 나트륨은 131 mmol/L (135–150)로 다소 낮게 측정되었다. 알칼리 인산분해효소(alkaline phosphatase, ALP) 135 IU/L (25–100), 감마 글루타밀 전이효소(gamma glutamyl transferase, GGT) 69 U/L (0–50), 백혈구 17,180/mm3, HS-CRP 7.51 mg/dL, 아밀라제 400 U/L (30–100), 리파아제 200 U/L (5–50)로 상승되어 있었고 CA 19–9도 42.57 U/mL (0.0–34.0)로 소폭 상승되어 있었다.
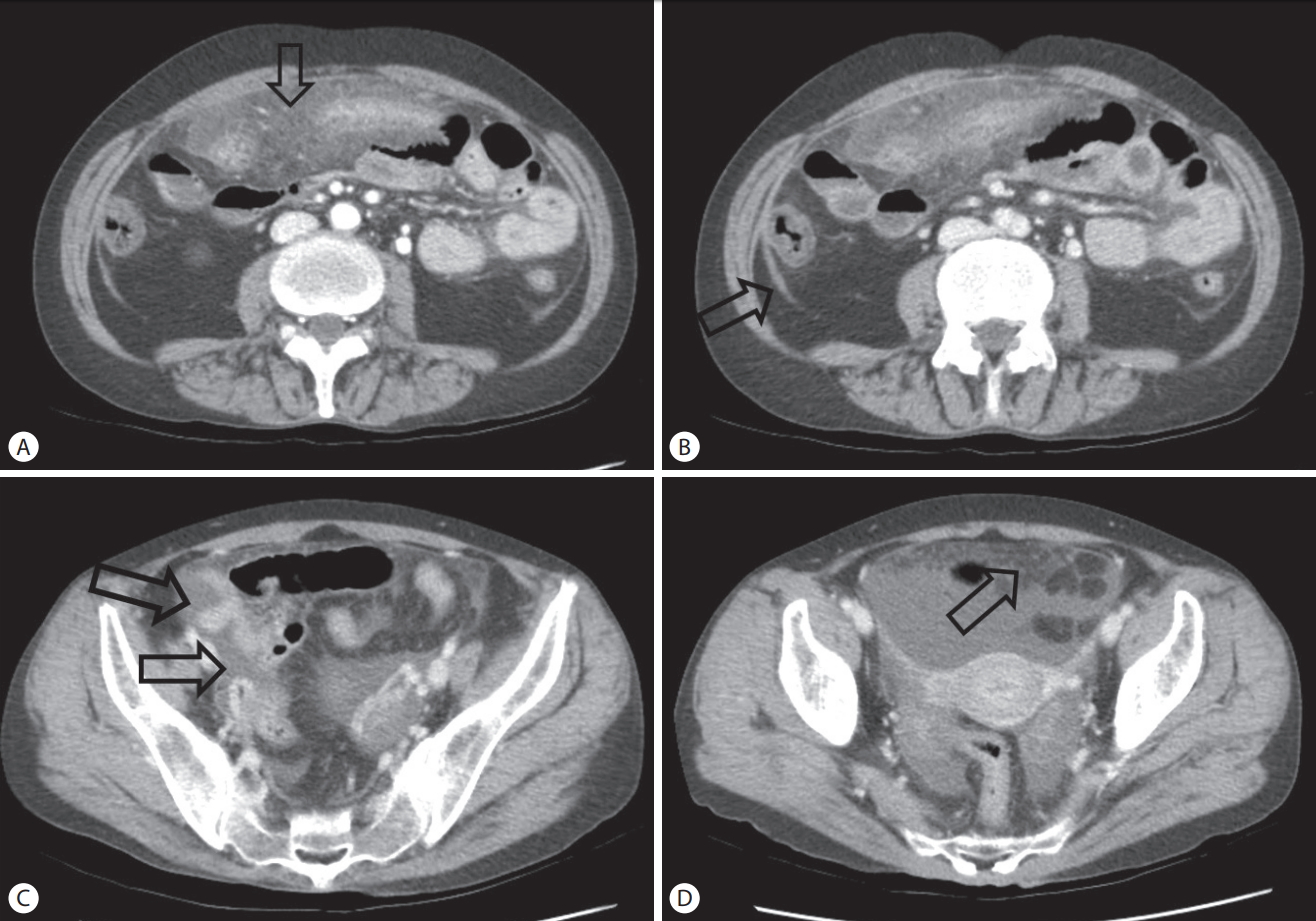
Computed tomography finding. Taken at another hospital. (A) Infiltration in the mesentery and omentum (arrow) were noted. (B) Peritoneal thickening (arrow) was noted. (C) Small amount of ascites (arrows) were noted. (D) Omental nodules (arrow) were noted.
본원에서 부인과적 검사를 시행하였고 골반 초음파에서 오른쪽 난소의 황체 낭종 외에는 이상소견이 없었다. 입원 당일 시행한 복부 전산화단층촬영에서 다량의 복수와 함께 위의 대만 주변에 3.2×2.8 cm 크기의 가성 낭종으로 보이는 액체 저류가 관찰되었다(Fig. 2). 이에 복수천자를 시행하였고 백혈구 1,650 cell/μL (<500), 절대 호중구수 1,369.5 cell/μL (<500)으로 상승소견을 보였고 아밀라제 >1,500 U/L (30–110), 리파아제 >2,000 U/L (5-50)로 상승되어 있었다. 복수의 단백질은 3.8 g/dL, 알부민 2.3 g/dL였고 혈청-복수 알부민 차(serum-ascites albumin gradient, SAAG)는 1.0 g/dL로 췌장성 복수를 시사하는 소견이었다. 복수에서 동정되는 세균은 없었으며 결핵균 배양 검사에서도 음성이었다. 병리학 검사에서도 악성 종양세포는 발견되지 않았다. 입원 다음날 시행한 자기공명췌담관조영술(magnetic resonance cholangiopancreatography, MRCP)에서는 췌장의 가성 낭종으로 보이는 병변 외에는 이상소견을 발견할 수 없었다. 내시경 초음파에서도 췌장 주변에서 암을 의심할 만한 병변은 없었다.
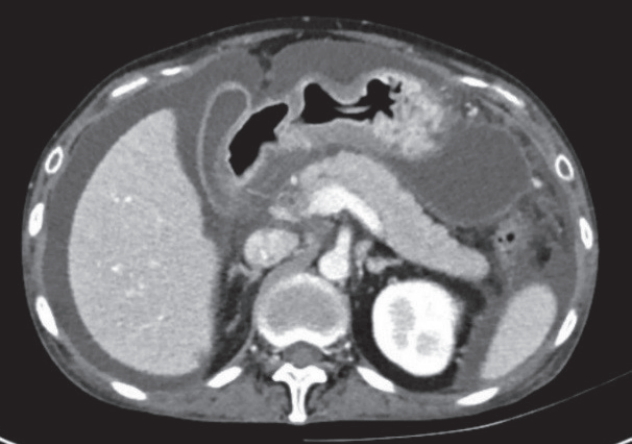
Computed tomography finding. At admission, massive amount of ascites and loculated fluid collection around stomach great curvature was noted.
이어서 시행한 내시경 역행성 췌관 조영술에서 췌관 누출로 보이는 부분이 관찰되었다(Fig. 3A). 이에 췌장액을 배액하기 위하여 내시경 비강 췌관 배액술(endoscopic nasopancreatic dranage, ENPD)을 시행하였다. 시술 당일에 흉부 단순촬영에서 관찰된 흉수에 대한 추가 검사를 위해 시행한 흉부 전산화단층촬영에서도 췌관 파열 부위가 확인되었다(Fig. 3B). 흉수는 양이 많지 않았고 호흡곤란 등의 증상을 유발하지 않아 원인질환 치료를 먼저 시행하기로 하고 천자를 시행하지 않았다.
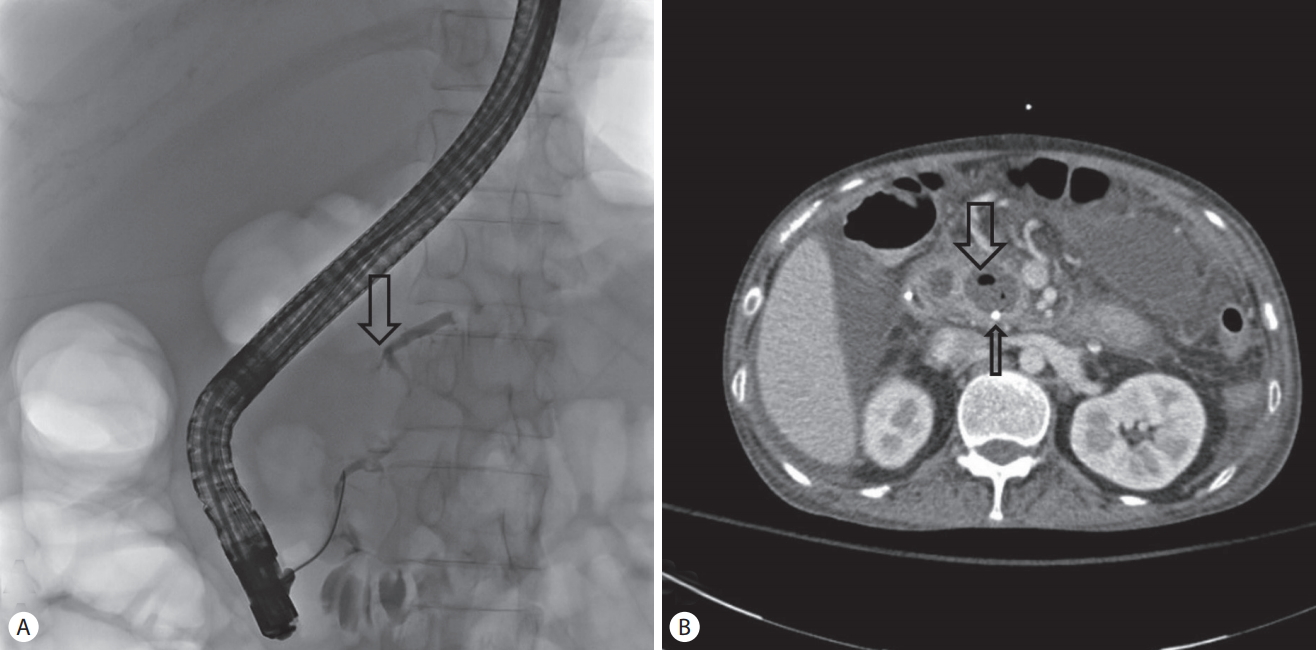
(A) ERCP finding. 1 day later, pancreatic duct leakage was suspected (arrow). (B) CT finding. After ENPD procedure, the pancreatic duct stent is visible (arrow) and air bubble in fluid collection surrounding pancreatic duct (wide arrow) was noted. ERCP, endoscopic retrograde cholangiopancreatography; CT, computed tomography; ENPD, endoscopic nasopancreatic dranage.
시술 4일 후(입원 5일 후)에 다시 진단적 복수천자를 시행하였고 아밀라제 177 U/L (30–110), 리파아제 79 U/L (5–50)로 이전에 비해 감소되었으며 혈청 아데노신 디아미나제(serum adenosine deaminase, ADA)는 9.2 IU/L (4–20)로 정상이었다. 이에 악성 종양의 가능성보다는 급성 췌장염 후의 췌장 가성 낭종과 복수로 진단하고 기존에 삽입한 ENPD를 통해 췌장액을 배액하며 치료하였다. 시술 6일 후 경과를 확인하기 위한 복부 전산화단층촬영에서 복수가 전반적으로 줄어든 것을 확인할 수 있었으나 위 대만부에 위치한 가성 낭종의 크기는 14×12 cm로 증가하였다(Fig. 4). 이에 다음날(내시경 비강 췌관 배액술을 시행한 지 7일째) ENPD를 제거하고 주췌관에 플라스틱 췌관 스텐트(7 Fr, 10 cm, single pigtail; Cook Medical, Bloomington, IN, USA)를 삽입하였고 가성 낭종에 대해서는 자가팽창 금속 스텐트(4 cm, dumbel like full covered self-expanding metal stent; Hanaro, Seoul, Korea)를 사용하여 내시경적 경벽 배액술(endoscopic transmural drainage)을 시행하였다.
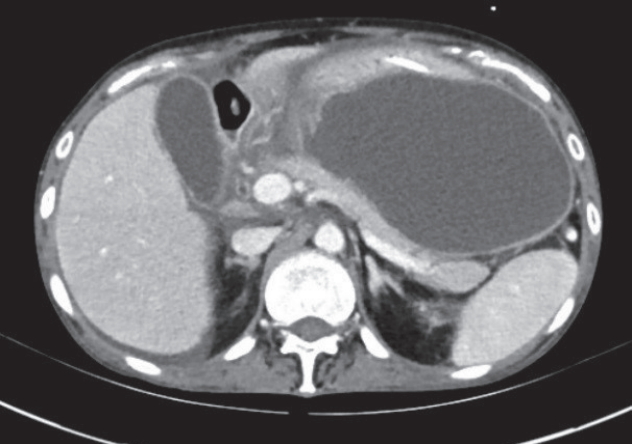
Computed tomography finding. A weeks later, ascites disappeared after drainage of pancreatic juice. But size of pseudocyst was increased to 14×12 cm.
2일 후 시행한 복부 전산화단층촬영에서 복수는 현저히 줄었으며 배액을 시도한 가성 낭종도 줄어든 것을 확인하였고, 시술 4일 후에 가성 낭종 내에 거치하였던 경비 낭종 배액관(nasocyst drainage)을 제거하였다. 이틀간 식사를 진행하며 경과관찰하였고 이상이 없는 것을 확인하고 퇴원하였다. 퇴원 후 외래에서 마지막 시술일로부터 15일째에 복부 전산화단층촬영 검사를 시행하였다. 복수는 거의 관찰되지 않았고 가성 낭종은 사라진 상태로 내부 배액을 위한 금속 스텐트는 정상 위치에서 관찰되었다(Fig. 5).
고 찰
급성 췌장염 후 복수가 발생하였을 때 복수의 원인으로 급성 췌장염의 합병증을 먼저 생각하지만, 복수가 광범위 하거나 체중감소 등의 임상증상이 동반될 경우 복강내 암종에 의한 복수의 가능성도 배제할 수 없다. 특히 복부 전산화단층촬영(computed tomography, CT) 등의 영상의학적 검사에서 복막암종이 의심된다는 소견과 혈액 검사에서 CA 125의 상승이 있을 때는 더욱 감별진단이 요구된다. 본 증례에서 타병원 CT검사 소견인 원발성 유두 장액성 복막암은 1959년에 처음 소개된 이후 미국에서 백만 명당 6.78명 정도의 발생률을 보이는 매우 드문 원발성 복막암종이다[3]. 그러나 전 세계적인 발생률은 아직 조사된 바 없고 평균 생존 기간이 23.5개월에 불과해 의심될 경우 감별진단이 필요하다[4]. CT에서는 대개 복수가 관찰되고 난소 등의 다른 원인 장기가 없는 상태에서 장막 및 복막이 두꺼워진 소견을 볼 수 있다. 경우에 따라서는 장막결절이 관찰되기도 한다[5]. PSPC의 전통적인 진단기준에 따르면 복막 종양이 상피성 난소암과 유사한 조직학적 소견을 보여야 한다. 그러나 복막을 미만성으로 침윤하는 경우가 많아 수술적인 조직검사 전에는 정확한 진단이 어려운 실정이다[6]. 그리고 PSPC환자에서 CA 125의 상승이 관찰되었을때 양성 또는 음성 예측률에 대한 정확한 보고는 알려져 있지 않으나 현재로서는 원발성 복막암의 가장 유효한 종양 표지자로 알려져 있다[7]. 본 증례의 경우도 타 병원 복부 전산화단층촬영에서 다량의 복수와 함께 복막과 장막이 두꺼워진 소견이 있었고, CA 125의 상승과 임상증상을 고려하여 복막암종의 감별이 필요하였다.
한편, 췌장성 복수는 주로 주 췌관의 파열로 인해 발생하거나 가성 낭종의 유출에 의해 발생한다[2]. 주 췌관의 파열은 급·만성 췌장염 발생시 췌관 주변의 국소적 염증반응과 단백질 플러그에 의한 췌관의 폐색으로 일어나는 것으로 알려져 있다[8]. 진단은 복수천자와 내시경적 역행적 췌관 조영술로 할 수 있다. 췌장성 복수의 경우 아밀라제가 1,000 U/L, 단백질의 경우 3.0 g/dL 이상인 것이 특징적 소견이다[9]. 본 증례에서는 복수 천자 검사에서 아밀라제는 1,500 U/L 이상, 단백질은 3.8 g/dL로 측정되었다. 복부 전산화단층촬영에서는 가성 낭종이 관찰되었고 복수천자액으로 시행한 병리학적 검사에서 종양세포가 발견되지 않았다. 본원으로 전원되기 전에 시행한 혈액검사에서 CA 125의 상승소견이 있었으나 본원 골반 초음파검사에서 오른쪽 난소의 황체 낭종이 발견되어 이로 인한 수치상승으로 판단하였다. 이상의 결과를 바탕으로 복막 암종보다는 췌장염 후 합병된 가성 낭종 및 췌장성 복수의 가능성이 높다고 판단하였다. 이어서 시행한 내시경적 역행적 췌관 조영술에서 췌관 파열 부위가 관찰되었다. 같은 날 흉부 X-ray에서 관찰된 흉수에 대한 추가 검사를 위하여 시행한 흉부 전산화단층촬영에서 췌관 파열이 의심되는 부위로 플라스틱 관이 삽입되어 있으며 시술 중 송기에 의하여 발생한 가스음영이 관찰되었고 췌관 파열을 확인하였다.
본 저자들이 경험한 증례는 처음에는 알코올로 인한 급성 췌장염으로 병원을 내원한 경우였다. 그리고 경과관찰 중에 합병증으로 가성 낭종 및 췌관의 손상으로 인한 췌장성 복수가 발생하였고 이후 3개월 가량 지속되면서 이차적으로 복막과 장막이 두꺼워진 소견이 복부 전산화단층촬영에서 관찰되었다. 이러한 영상의학적 소견과 함께 혈청 CA 125가 81.42 U/mL (0–35)로 상승되었고 5 kg 가량의 체중감소도 동반되어 PSPC의 가능성까지 의심하게 되었다. 본원으로 전원되었을 당시에 환자는 이미 암의 가능성을 전해 듣고 불안한 상태였고 의료진도 이학적 검사와 타 병원 검사 결과 등을 참고하였을 때 암의 가능성을 배제할 수 없었다. 그러나 모든 경과의 시작이 급성 췌장염의 합병증이라는 점에 착안하여 먼저 광범위한 복수를 해결하기 위해 복수천자를 시행하였고, 복수의 원인이 췌장성이라는 것을 확인하였다. 그 후 ENPD로 복수의 원인이 되는 췌관 파열을 치료하였고, 이후에는 가성 낭종에 대한 치료까지 시행함으로써 PSPC의 조직병리학적 진단을 위한 수술적 처치 없이도 감별진단이 가능하였다.
Notes
Conflict of Interest
The authors have no conflicts to disclose.