항암화학요법과 수술적 절제로 완전 관해된 전이를 동반한 십이지장 신경내분비암
Complete Remission of Metastatic Duodenal Neuroendocrine Carcinoma Treated with Chemotherapy and Surgical Resection
Article information
Abstract
유문 주위의 십이지장 종괴로 내원한 57세 남자 환자가 grade 3의 십이지장 신경내분비암과 다발성 간 전이로 진단되었다. 9주기의 cisplatin, etoposide 병합 항암화학요법으로 치료받은 후 복부 전산화단층촬영에서 원발 십이지장 종괴의 완전 퇴행과 간 전이 병변의 현격한 크기 감소가 관찰되었다. 양전자방출단층촬영에서는 대사성 완전 관해 소견을 보였다. 유문보존 췌십이지장 절제술을 시행하였고, 5 mm 크기의 잔존하는 신경내분비종양이 병리학적으로 확인되었다. 환자는 처음 진단 이후 43개월 이상 재발의 증거 없이 생존 중이다. 본 증례는 grade 3의 신경내분비암의 이질성에 대한 가능성을 제시하고, 일부 환자들은 cisplatin, etoposide 병합 항암화학 요법에 매우 좋은 반응성을 보여 완전 관해를 얻을 수 있음을 시사한다.
Trans Abstract
A 57-year-old male with periampullary duodenal mass was diagnosed as grade 3 duodenal neuroendocrine carcinoma with multiple liver metastasis. After nine cycles of cisplatin and etoposide, abdominal computed tomography (CT) findings showed complete regression of primary duodenal mass with marked size reduction of liver metastasis. Positron emission tomography findings showed metabolic complete response in both duodenal and liver mass. Pylorus-preserving pancreaticoduodenectomy was done and pathologic finding showed 5 mm sized remnant neuroendocrine tumor. The patient has remained alive with no evidence of disease for 43 months after initial diagnosis. This case suggests the possibility of heterogeneous nature of grade 3 neuroendocrine carcinoma and selected population may have extreme sensitivity to cisplatin and etoposide chemotherapy leading to complete response.
서 론
소화기계 신경내분비종양(gastroenteropancreatic neuroendocrine tumor)은 신경내분비세포에서 기원한 상피세포 종양으로, 췌장과 소화기계의 모든 장소에서 발생할 수 있다. 이 중 십이지장에 발생하는 경우는 희소하여 전체 소화기계 신경내분비종양의 약 2%를 차지하고, 유병률은 10만 명당 0.19명으로 보고된 바 있다[1]. 대부분의 십이지장 신경내분비 종양은 2 cm 미만의 단일 종괴로 점막과 점막하층에 국한되어 있지만, 10% 미만에서 간 전이가 발견된다고 알려져 있다. 하지만 2010년 개정된 World Health Organization (WHO) 분류상 grade 3의 신경내분비암(neuroendocrine carcinoma)의 경우 십이지장에서는 3% 미만으로 드물게 발견되나 유문부 주위에 발생하며 대부분 진단시 간 전이를 동반한다[2].
2016년 제시된 유럽 신경내분비종양학회(European Neuroendocrine Tumor Society) 가이드라인에 따르면 국소화된 grade 3의 신경내분비암은 근치적 절제를 시도할 수 있으나 단독 치료로는 재발률이 높아 보조 항암화학요법을 추천하고 있으며, 절제가 불가능하거나 원격 전이가 동반된 경우 항암화학요법만이 생존기간을 연장할 수 있는 유일한 방법으로 제시되어 있다[3]. 하지만 최적의 항암화학요법을 받은 경우에도 전이가 동반된 grade 3의 신경내분비암의 중앙 전체생존기간(median overall survival)은 15-18개월로 짧으며, 일차 항암화학요법이 실패한 경우 이차 항암화학요법으로 정립된 것이 없어 전체적으로 예후는 매우 불량하다.
저자들은 다발성 간 전이를 동반한 grade 3의 십이지장 신경내분비암 환자에서 cisplatin, etoposide 병합 항암화학요법으로 완전 관해를 얻고, 유문보존 췌십이지장 절제술 후 재발의 증거 없이 43개월 이상 장기 생존 중인 환자 1예를 경험하여 문헌 고찰과 함께 보고한다.
증 례
57세 남자가 건강검진에서 시행한 상부위장관 내시경에서 발견된 십이지장 대유두의 종괴를 주소로 내원하였다. 복부통증 및 자각증상은 없었으며 황달, 체중 감소는 동반되지 않았다. 환자는 고혈압, 당뇨, 간질환을 포함한 이전 특이병력이 없었으며 가족력도 특이사항은 없었다. 흡연 및 음주는 부인하였다.
일반혈액검사에서는 백혈구 6,780/mm3 (호중구 58.6%), 혈색소 13.9 g/dL, 혈소판 256,000/mm3였고, 일반화학검사에서 총 단백 7.4 g/dL, 알부민 4.6 g/dL, 총 빌리루빈 0.5 mg/dL, Alkaline phosphatase 57 IU/L, AST 20 IU/L, ALT 22 IU/L, γ-GT 53 IU/L, 크레아티닌 1.21 mg/dL였다. 혈청 암표지자 검사에서는 CA 19-9 2 U/mL로 정상 범위 내 수치였다. 상부위장관 내시경 검사에서 십이지장 대유두의 근위부에 2 cm 크기의 종괴가 관찰되었으며, 점막 미란과 자연 출혈이 동반되었다(Fig. 1). 복부 전산화단층촬영과 복부 자기공명영상에서는 십이지장 유두 주위에 2.5 cm 크기의 후기 조영증강되는 종괴가 발견되었다. 췌장 두부 주변의 림프절 비대 소견이 관찰되었지만 총담관과 주췌관의 확장 소견은 없었다. 간 5번과 6번 분엽에 전이로 의심되는 1.5-2 cm 크기의 결절들이 총 3개 발견되었다(Fig. 2A). 상기 병변들은 양전자방출단층촬영에서 고대사성 병변으로 확인되었다(Fig. 2B).
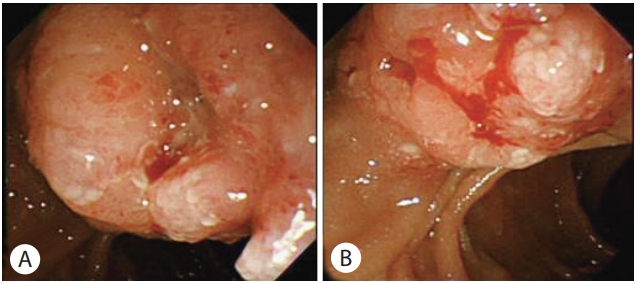
Initial endoscopic findings. (A) About 2 cm sized mass was identified proximal to the major papilla of duodenum. (B) Mucosal erosion and spontaneous bleeding was observed.
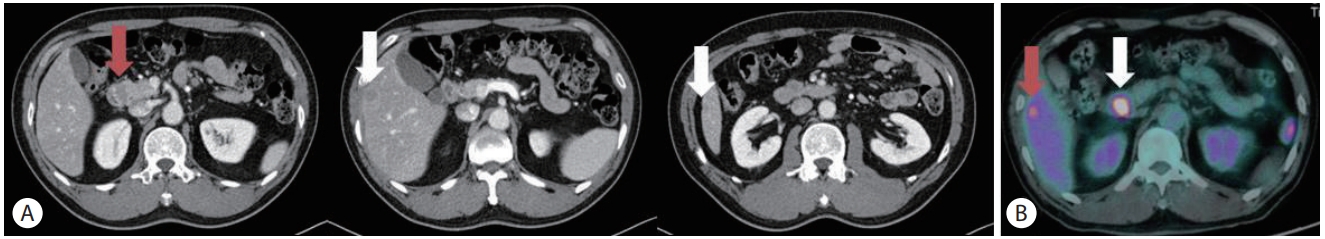
Initial abdominal CT and PET findings. (A) Initial abdominal CT findings. A 2.5 cm sized hypoattenuating periampullary mass showing delayed peripheral enhancement was detected (red arrow). Bile duct and pancreatic duct was normal. Metastatic lymph node was identified near the pancreas head. About 1.5 to 2 cm sized three hypoattenuating hepatic nodules were detected (white arrows), two at segment 5 (only one is shown) and the other at segment 6 of liver. (B) Initial PET findings. Hypermetabolic mass was detected at 2nd portion of duodenum (white arrow). Standardized uptake value was 10.3. Hepatic nodules found on CT were also hypermetabolic (only one at segment 6 [red arrow] is shown). CT, computed tomography; PET, positron emission tomography.
십이지장 대유두 근위부의 종괴 및 간 5번 분엽의 결절에서 각각 조직 검사를 시행하였다. 십이지장 조직 검사 결과에서는 고등급 이형성(high grade dysplasia)을 보이는 비정형 세포들이 관찰되었지만 침습적 샘암종은 관찰되지 않았다. 간 조직 검사 결과에서는 저분화 암종(poorly differentiated carcinoma) 소견이 관찰되었고, 면역조직화학 검사에서 synaptophysin, chromogranin A, CD56에 양성 및 P63에 음성 소견, Ki-67 지수 50%로 나타나(Fig. 3) WHO 분류에 따라 grade 3의 십이지장 신경내분비암과 다발성 간 전이로 진단하였다. 고식적 목적으로 2015년 2월부터 총 11개월 동안 9주기의 cisplatin, etoposide 병합 항암화학요법으로 치료하였다.

Microscopic findings of liver biopsy specimen. (A) Nests of atypical cells with hyperchromatic, pleomorphic nuclei were observed (H&E stain, ×400). (B) Tumor cells revealed strong, diffuse expression of chromogranin and CD56. Positive stain of synaptophysin was detected. P63 was negative (P63 stain, ×200; chromogranin A stain, ×200; CD56 stain, ×200; synaptophysin stain, ×200 as labeled).
항암화학요법을 9주기 시행한 후 촬영한 복부 전산화단층촬영 결과 십이지장의 종괴는 관찰되지 않았으며 간 전이 병변들은 모두 5 mm 미만으로 크기가 감소하였다(Fig. 4A). 양전자방출단층촬영에서는 이전에 발견된 고대사성 병변들의 표준화섭취계수(standardized uptake value)가 정상화된 소견이 확인되었다(Fig. 4B). 영상학적인 관해로 판단되어 항암화학요법을 중단하였고 1년 후 추적 복부 전산화단층촬영 및 자기공명영상에서 간 전이 병변들의 크기가 이전보다 더 감소하였다(Fig. 4C). 상부위장관 내시경 결과 이전에 발견된 종괴의 크기가 현저히 감소하였고 같은 위치에 잔존하는 점막 표면의 결절성 병변에서 조직 검사를 시행하였다(Fig. 4D). 조직 검사 결과 신경내분비종양이 확인되었다. 환자는 2017년 7월에 유문보존 췌십이지장 절제술을 시행받았으며 십이지장 대유두 근위부에 5 mm 크기의 결절성 병변이 관찰되었다. 수술 검체의 병리 소견에서 유두괄약근으로의 침윤이 확인되었지만 췌장실질 및 주요 혈관은 침범하지 않았으며 림프절 전이는 없었다. 유사분열은 10개의 고배율 시야당 1개가 관찰되었고 면역조직화학 검사에서 synaptophysin 양성, Ki-67 지수 1%로 WHO 분류상 grade 1의 신경내분비 종양으로 확인되었다. 이후로 6개월 뒤 추적 복부 초음파 검사와 12개월 뒤 복부 전산화단층촬영에서 재발 소견은 없었으며 현재까지 환자는 진단 이후 43개월 이상 생존 중이다(Fig. 5).
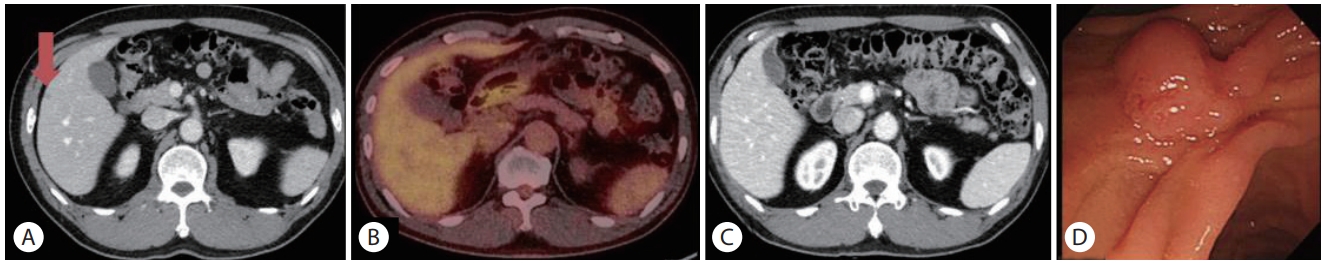
Follow up image findings after chemotherapy. (A) Abdominal CT findings after nine cycles of cisplatin and etoposide chemotherapy. Complete regression of primary duodenal mass was identified. Previous detected metastatic hepatic nodules decreased in size to less than 5 mm (red arrow). (B) PET findings after nine cycles of cisplatin and etoposide chemotherapy. Markedly decreased and normalized metabolism of duodenal mass and hepatic nodules was identified. (C) Abdominal CT findings 1 year after the termination of chemotherapy. Previous detected metastatic hepatic nodules decreased in size and could not be clearly demarcated. (D) Endoscopic findings 15 months after the termination of chemotherapy. Duodenal mass was markedly decreased in size. Some nodularity was observed at the mucosal surface. CT, computed tomography; PET, positron emission tomography.
고 찰
십이지장 신경내분비종양은 대부분 느린 경과를 가진 고분화된 비기능성 종양으로, 국소화된 단일 종괴로 우연히 발견되어 근치적 절제로 치료하는 것이 일반적이다. 하지만 주로 유문부나 유문부 주위에 발생하는 grade 3의 신경내분비암은 비록 3% 미만으로 드물게 발견되나 진단 당시 림프절 전이와 간 전이를 동반하여 근치적 절제가 불가능한 경우가 대부분이다[2]. 분화도가 좋은 grade 1, grade 2의 신경내분비암은 간 전이가 동반된 경우에도 부피감소 수술(debulking surgery)과 고주파절제술이 생존기간을 향상시킴이 알려져 있고, 절제가 불가능한 경우 소마토스타틴 유사체나 분자표적 치료로 everolimus를 사용할 수 있으나 전이가 동반된 grade 3의 신경내분비암은 전신 항암화학요법이 최선의 치료방법이다[3,4]. 발생 위치에 관계없이 grade 3의 신경내분비암은 생물학적 및 형태학적으로 폐의 소세포암 및 대세포암과 유사하다는 관찰에 근거하여 cisplatin, etoposide의 병합 항암화학요법이 일차치료로 제시되고 있다[3,5].
본 증례는 상부위장관 내시경에서 우연히 발견된 십이지장 대유두의 종괴로 내원한 환자에서 다발성 간 전이 및 Ki-67 지수 50%인 grade 3 신경내분비암이 진단되어 9주기의 cisplatin, etoposide 병합 항암화학요법으로 영상학적 완전 관해를 얻고 원발 부위를 수술적 절제하여 43개월 이상 장기 생존한 증례이다. Grade 3의 신경내분비암은 치료하지 않을 경우 중앙생존기간이 6-7개월으로 불량한 자연경과를 보인다[6]. 여러 연구에서 cisplatin, etoposide의 병합 항암화학요법이 중앙 생존기간을 약 15-18개월로 연장시킨다고 보고하고 있지만, 아직 전향적 무작위 임상연구는 진행된 바가 없다(Table 1). 종양 자체는 항암제에 민감하게 반응하여 반응률(response rate)이 30-75%로 높은 편이지만, 완전 관해되는 경우는 극히 적으며 약 9개월이 지난 후에는 대부분 항암제 내성이 발생하여 암이 진행되는 것이 최근 환자 치료에 있어 가장 큰 문제이다. 이에 oxaliplatin 기반 항암요법, irinotecan 기반 항암요법 및 temozolomide 기반 항암요법이 이차 항암화학요법으로 시도되고 있으나 그 근거가 부족하고 반응률이 10-30% 미만으로 한계가 있다[3]. 본 증례에서 다발성 간 전이가 있었음에도 11개월간 항암제에 반응하여 영상학적 완전 관해된 후 43개월 이상 생존한 것은 기존 연구들의 보고와 다른 드문 증례로 사료된다.
최근 grade 3의 신경내분비암에서 항암요법의 반응성에 대한 분석에 기초하여 신경내분비암은 하나의 그룹으로 묶기에는 서로 이질적인 특성을 가진 소그룹이 존재하며, 종양의 분화도와 Ki-67 지수에 따라 분류를 더욱 세분화해야 한다는 관점이 있다[7]. Sorbye 등[8]의 보고에 따르면, Ki-67 지수가 55% 이상인 환자군 133명과 55% 미만인 환자군 115명을 비교하였을 때 Ki-67 지수가 55% 이상인 환자군에서 항암 치료에 대한 반응률은 높았지만(42% vs. 15%, p <0.001) 중앙생존기간은 더 짧았다(10 vs. 14 months, p <0.001). Milione 등[9]의 보고에서는 총 136명의 환자에서 grade 3의 신경내분비 종양을 Ki-67 지수가 21-55%이며 고분화된 것을 type A, Ki-67 지수가 21-55%이며 저분화된 것을 type B, Ki-67 지수가 55%보다 높으며 저분화된 것을 type C로 3가지 분류로 세분화하여 분석하였을 때 중앙생존기간이 각각 43.6개월, 24.5개월, 5.3개월(p <0.0001)로 나타났다. 이와 같은 분석 결과를 기초로 Ki-67 지수가 55%보다 높고 저분화된 신경내분비암은 기존의 항암화학요법을 추천하지만, 기존 항암화학요법의 효과가 적다고 보고된 Ki-67 지수가 21-55%이며 저분화된 신경내분비암은 oxaliplatin 기반의 항암화학요법을 초치료로 시도하며 Ki-67 지수가 21-55%이며 고분화된 신경내분비암은 부피감소 수술, 소마토스타틴 유사체, 분자표적 치료, 펩티드 수용체 방사선핵종 치료(peptide receptor radionuclide therapy) 등과 같은 grade 2의 신경내분비종양의 치료에 준하여 치료하는 시도들이 있다. 그러나 Walter 등[10]의 보고에서는 Ki-67 지수에 따른 중앙생존기간의 차이가 유의하게 나타나지 않았고, 기존 보고들에서도 무진행생존(pregression-free survival)이 일관되지 않은 결과가 나타나는 등 한계점이 있어 아직 grade 3의 신경내분비암의 세분화에 대한 논란의 여지가 있다.
결론적으로, 본 증례는 간 전이가 동반된 grade 3의 신경내분비암 환자에서 기존 cisplatin, etoposide 병합 항암요법만으로 간 전이가 영상학적 완전 관해되어 원발 부위인 십이지장을 수술하였고 재발의 증거 없이 장기 생존 중인 드문 예이다. 이는 최근 grade 3의 신경내분비암을 세분화해야 한다는 지견을 뒷받침하며, 이를 위하여 앞으로 항암 치료의 반응성과 관련된 지표에 대한 연구들이 더욱 필요할 것으로 사료된다.
Notes
Conflict of Interest
The authors have no conflicts to disclose.