만성췌장염에서 췌장암의 감시
Surveillance for Pancreatic Cancer in Chronic Pancreatitis
Article information
Abstract
해마다 전 세계적으로 췌장암은 10만 명당 10명 정도 발생하고, 만성췌장염은 5-12명 정도 발생하는 비교적 흔하지 않은 질환이다. 만성췌장염은 췌장암의 잘 알려진 위험인자이며, 췌장암에 대한 정상군 대비 총 상대위험도는 2.7에서 13.3까지 다양하게 보고되고 있는데, 이는 만성췌장염의 유병 기간, 흡연, 음주, 식사 및 신체활동, 당뇨 발생 등 여러 인자와 관련되어 있다. 췌장암의 유병률이 높지 않기 때문에 모든 만성췌장염 환자에서 췌장암의 선별 검사를 하는 것은 권장되지 않는다. 따라서 만성췌장염 환자 중 췌장암의 위험도가 높은 소집단을 찾아내는 것이 필요하다. 다양한 위험인자와 그것들의 췌장암에 미치는 영향을 알아내고 이를 기반으로 영상 검사, 바이오마커 검사 등을 이용한 췌장암 감시를 하도록 해야 하겠다.
Trans Abstract
Pancreatic cancer can arise in the background of chronic pancreatitis (CP). The relative risks for pancreatic cancer in CP vary considerably according to other contributing factors such as disease duration, excess alcohol consumption, tobacco consumption, eating habits, physical activity, and late-onset diabetes. The incidence of pancreatic cancer is estimated to be about 10 per 105 per year, and the incidence and prevalence of CP are estimated to be 5-12 per 105 and 50 per 105 per year, respectively. The pooled relative risk estimates for pancreatic cancer in CP patients range from 2.7 to 13.3. Subsets of CP subjects with a family history of pancreatic cancer or those with newly developed diabetes over the age of 50 have a higher risk for pancreatic cancer. However, the prevalence of pancreatic cancer is not high enough to justify general screening of the adult CP population. Thus, it is necessary to select subsets of CP cohorts with a significantly high risk of pancreatic cancer. We need a better overall disease model that can define the interaction of multiple risk factors and their cumulative or potential effects on pancreatic cancer.
서 론
만성췌장염은 병리학적으로 췌장 샘꽈리세포의 소실, 만성 염증세포의 침착, 섬유화 등 췌장의 비가역적인 조직 손상을 보이고 다양한 유전적, 환경적, 생활 습관 등의 요인이 복합적으로 기여하는 질환이다[1]. 췌장암은 만성췌장염 배경하에 발생할 수 있으며, 만성췌장염에서 췌장암에 대한 총상대위험도(pooled relative risk)는 만성췌장염의 유병 기간, 흡연, 음주, 음식, 신체활동, 당뇨 등에 따라 2.7에서 13.3까지 다양하게 보고되고 있다[2-5]. 특히 췌장암의 가족력이 있거나 50세 이상에서 새로 발생한 당뇨 등이 있는 경우 높은 위험도를 보이는 것으로 알려져 있다. 전 세계적으로 해마다 10만 명당 10명 정도 췌장암이 발생하고, 만성췌장염은 5-12명이 발생하는 비교적 흔하지 않은 질환이다[6-9]. 선별 검사에서 중요한 것은 질환의 유병률, 선별 검사의 정확성, 비용 대비 효과 등인데[10,11], 췌장암의 유병률이 전체 만성췌장염 환자 모두에서 선별 검사가 필요할 정도로 높지 않기 때문에 보다 높은 췌장암의 위험을 지니는 만성췌장염 환자를 선별하여 감시하는 것이 필요하다[12,13]. 이에 만성췌장염에서 췌장암의 발생에 관한 역학과 관련된 인자들, 감시 방법 등에 대해 알아보고자 한다.
본 론
1. 역학
여러 연구에서 만성췌장염에서 발생하는 췌장암의 빈도를 제시하였는데, 발생률은 1.0%에서 3.7%까지 다양하였고 만성췌장염 진단 1년 혹은 2년 이후 발생하는 췌장암을 포함하였다(Table 1) [6,9,14-17]. 표준화 발생비(standardized incidence ratio, SIR)는 7.6에서 68.1까지 보고되어서 만성췌장염은 정상군 대비 췌장암의 위험도가 높음을 보여준다[6,7,9,18,19]. 연구 결과에서 췌장암에 대한 SIR이 다양하게 보고된 것은 생활 습관, 기저 질환, 유병 기간 등의 다양한 인자가 영향을 주었을 것으로 생각되며, 또한 어떠한 정의의 만성췌장염 환자를 어떻게 선별하여 포함하는지도 영향을 미친다. Kirkegård 등[4]의 메타분석에서는 만성췌장염 진단 1년이후에 발생하는 췌장암의 비교위험도가 6.09 (95% confidence interval [CI], 3.79-9.79), 진단 2년 이후 16.16 (95% CI, 12.6-20.7), 진단 5년 이후 7.90 (95% CI, 4.26-14.7), 진단 9년 이후 3.53 (95% CI, 1.06-73.8)으로 보고되어, 만성췌장염 진단 이후 2년 이후가 가장 췌장암의 위험도가 높았고 이후 점점 감소되는 것을 보여주었다. Tong 등[20]의 메타분석에서는 1년 이내 발생한 췌장암의 위험도가 23.3 (95% CI, 14.0-38.9)으로 매우 높았고 2년, 5년, 10년 이후 발생하는 췌장암의 위험도는 각각 3.03, 2.82, 2.25로 유사하였다. 따라서 비교적 만성췌장염 진단 초기에 췌장암의 위험도가 높으며 5년 이후로는 위험도가 낮아지지만 췌장암이 꾸준하게 발생하는 것을 알 수 있다.
2. 유전자 변이와 연관된 만성췌장염
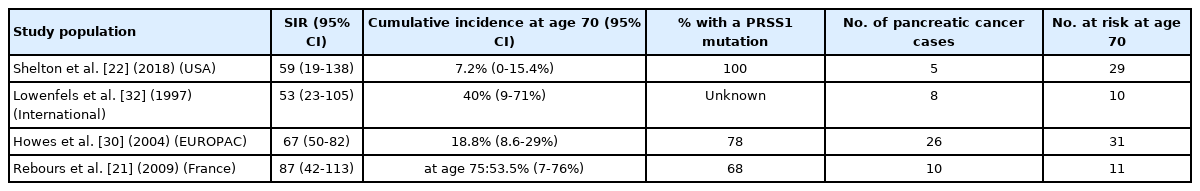
이전의 연구에서 유전성 췌장염에서 췌장암의 발생은 SIR이 53-87로 보고되어 매우 높은 췌장암의 발생을 보여주었다(Table 2). 산발성 만성췌장염(sporadic chronic pancreatitis)과 달리 protease serine 1 (PRSS1) 유전자의 기능 획득(gain-of-function) 변이에 의한 상염색체 우성의 유전성 만성췌장염은 상대위험도가 87에 이를 정도로 매우 높은 췌장암의 위험을 보인다[21,22]. 따라서 유전적으로 PRSS1 변이를 보이는 상염색체 우성 유전성 췌장염의 과거력이 있는 경우 췌장암 감시의 대상이 된다. 만성췌장염 환자에서 cystic fibrosis transmembrane conductance regulator (CFTR) 변이는 췌장암의 상대위험도를 약간 증가시키는 것으로 알려졌다[23-25]. 다른 serine protease inhibitor Kazal type 1 (SPINK1), chymotrypsin C (CTRC), carboxyl-ester lipase (CEL) 등의 유전자 변이는 만성췌장염에서 췌장암과 직접적인 연관이 증명되지 않았다[26-29]. 따라서 만성췌장염 환자에서 CFTR, SPINK1, CTRC, CPA1, CEL 등의 다른 생식세포 돌연변이가 있는 경우는 췌장암 감시를 할만큼 췌장암의 위험도가 충분히 높지 않다[5].
3. 산발성 만성췌장염의 췌장암 위험인자
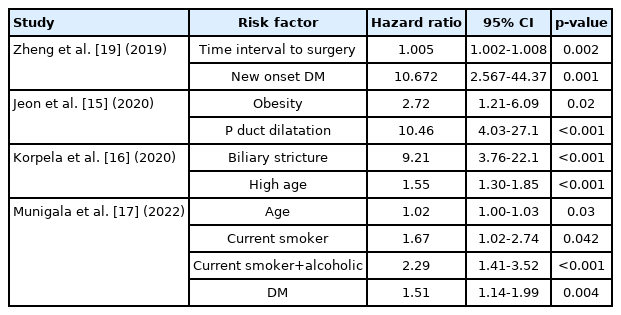
산발성 만성췌장염에서 생기는 췌장암의 유병률이 높지 않기 때문에, 이들 환자 모두에서 췌장암을 감시하는 것은 적합하지 않다. 이전 연구에서 비만, 췌관확장, 담관협착, 고령, 새로 발생한 당뇨, 흡연, 음주 등이 만성췌장염에서 췌장암의 발생과 연관된다고 보고되었다[15-17,19]. 이 중 새롭게 발생한 당뇨, 췌관확장, 담관확장 등은 각각 10.7, 10.5, 9.2로 높은 비교위험도를 보여주었다(Table 3)[15,16,19]. 따라서 이러한 위험인자가 있는 만성췌장염 환자는 췌장암 감시가 권장된다. 다만 어떠한 위험인자가 췌장암과 어느 정도로 연관이 있는지, 그러한 위험인자를 가진 만성췌장염 환자에서 어떻게 췌장암 감시를 시행할지는 추가 연구가 필요하다.
4. 췌장암 감시의 방법, 시작, 종료
췌장암 조기 발견을 위한 표준 선별 검사 방법은 아직까지 정립되지 않았다. 췌장암 진단의 표준 방법인 컴퓨터단층촬영(computed tomography, CT)과 역시 효과적인 자기공명영상 (magnetic resonance imaging, MRI), 자기공명담췌관조영술(magnetic resonance cholangiopancreatography)은 만성췌장염에서도 췌장암을 스크리닝 하기 위한 유용한 영상 검사이다. 초음파 내시경도 좋은 검사 방법이나 만성췌장염의 실질 염증, 섬유화, 석회화 등의 배경에서 췌장암을 발견하는 것은 어려움이 있을 수 있다.
유럽의 유전성 췌장염 연구에서 418명의 유전성 췌장염 환자 중 26명(6%)에서 췌장암이 생겼고 그 위험도는 40세 이후 증가하였으며[30], 다른 연구에서도 유사한 결과를 보여 유전성 췌장염의 경우 40세부터 선별 검사를 시행하는 것이 권장된다. 단, 40세 이전의 췌장암을 놓치는 확률과 40세 이전부터 검사할 경우 추가되는 비용 대비 효과를 고려하여야 한다. Lowenfels 등[31]의 497명의 유전성 췌장염 연구에서 19명의 췌장암이 발견되었고 40세 이전의 췌장암은 3명이었으며 모두 흡연자여서, 비흡연자에서 40세 이전에 선별 검사를 하는 것은 효과적이지 않을 것으로 생각된다. 산발성 만성췌장염 환자는 위험인자가 있는 경우 췌장암 감시를 시작하도록 한다. 감시 주기는 검사 방법에 따라 다를 수 있으며 감시의 종료 나이는 정해지 않았으나, 췌장암이 진단되더라도 전신 상태가 수술적 치료 혹은 항암 치료를 받을 수 없다면 췌장암 감시의 종료가 권장된다.
5. 생활습관 관리 및 수술
만성췌장염의 진행을 막아 직간접적으로 췌장암 발생의 위험을 줄이도록 해야 한다. 환자는 금연, 금주를 하도록 해야 하며, 과일과 채소가 포함된, 엽산이 풍부한 과일 채소와, 적정량의 붉은 고기가 들어있는 균형 잡힌 건강식을 하도록 해야 한다. 또한 규칙적인 충분한 운동을 하고 비만이 되지 않도록 노력해야 한다. 만성췌장염에 대한 수술적 치료가 췌장암의 발생을 낮추었다고 보고된 바 있어 필요한 경우 수술적 치료도 고려되어야 하겠다[18].
결 론
만성췌장염은 췌장암의 주요한 위험군이며, 유전성 만성췌장염의 경우 췌장암의 위험도가 높아 PRSS1 유전자의 변이가 있을 때는 췌장암의 감시가 필요하다. 산발성 만성췌장염에서 췌장암 위험인자를 찾아 이해 해당하는 경우 선별검사를 시행한다. 유전성 만성췌장염은 40세 이후 감시가 필요하며, 만성췌장염에서 췌장암 선별 검사의 방법으로 CT 또는 MRI가 적합하다. 만성췌장염의 진행과 췌장암의 위험을 줄이기 위해 생활습관 교정 및 식이 관리를 해야 한다. 다양한 위험인자와 그것들의 췌장암에 대한 누적영향을 평가하는 모델을 구축하여 향후 이를 이용한 조기 발견의 평가가 이루어지는 것이 필요할 것이다.
Notes
Conflict of Interest
The author has no conflicts to disclose.