고녹말분해효소혈증과 고지방분해효소혈증의 임상적 접근
Approach to Hyperamylasemia and Hyperlipasemia
Article information
Abstract
고효소혈증(고녹말분해효소제혈증, 고지방분해효소 제혈증)은 혈행으로 유입되는 효소의 양이 많아지거나 혈행으로부터 제거되는 효소가 적어지는 경우에 발생하게 된다. 소화관으로 외분비 되어야 할 녹말분해효소와 지방분해효소가 혈행으로 유입되는 가장 중요한 기전은 녹말분해효소와 지방분해효소를 생산하는 췌장의 선방세포 내에서 선단막을 통한 효소의 정상적인 외분비가 차단되고, 기저측면막을 통한 효소의 누출이 증가하는 것이다. 이러한 누출 과정은 대다수가 병적인 상황에서 발생하지만 Gullo 증후군과 같이 췌장에 특별한 병증이 없이 원인 미상으로 발생하기도 한다. 또한 이러한 누출 과정은 췌장뿐 아니라 녹말분해효소와 지방분해효소를 분비하는 췌장 외 기관에서도 동일한 기전으로 발생할 수 있다. 소장의 염증성 질환에 의해 소장 점막의 혈관투과성이 증가하면서 정상적으로 소장으로 외분비 된 녹말분해효소와 지방분해효소가 소장의 점막으로 흡수되어 혈관으로 유입되는 것도 효소 상승의 중요한 기전이다. 혈행으로 유입되는 효소와는 무관하게 신장과 간의 질환으로 인해 혈중 녹말분해효소와 지방분해효소가 배설, 대사되지 못하거나, 거대효소혈증이 발생하면서 면역글로불린과 결합된 효소가 신장을 통해 배설되지 못하는 경우도 간과되어서는 안 될 혈중 효소 상승의 중요한 기전이다.
Trans Abstract
Hyperamylasemia and hyperlipidemia occur when the amounts of amylase and lipase that enter the blood overweigh the kidney and liver reticuloendothelial system clearance of the enzymes. In normal homeostasis, most of these enzymes are excreted from the apical membrane of the acinar cells into the ductal system of the gland. However, in pathological conditions, this apical exocytosis is blocked, and the leakage of these enzymes at the basolateral membrane is increased. Therefore, these enzymes are released into the bloodstream. Many different pancreatic pathologies and Gullo syndrome can cause this type of leakage in the pancreas. This mechanism can also cause basolateral leakage in other organs that secrete amylase and lipase. In small bowel inflammatory conditions, amylase and lipase are absorbed through the inflamed mucosa and introduced into the bloodstream due to increased vascular permeability. Regardless of the enzymes that enter the blood circulation, several kidney and liver diseases prevent the excretion and metabolism of serum amylase and lipase. When the amylase and lipase are combined with immunoglobulins, they escape normal glomerular filtration due to the development of macroenzymes and accumulate in the blood. These situations related to the clearance of the enzymes are also crucial mechanisms of serum enzyme elevation that should not be overlooked.
서 론
췌장은 탄수화물 분해효소인 녹말분해효소(amylase), 지방분해효소(lipase), 그리고 단백 분해효소인 트립신(trypsin)과 같은 다양한 췌효소(pancreatic enzyme)들을 분비하여 섭취된 영양소의 소화를 촉진한다. 따라서 혈중 녹말분해효소 혹은 지방분해효소의 상승이 관찰되는 경우에는 췌장염, 췌장암으로 대표되는 췌장의 양성, 악성 질환을 배제하기 위해 다양한 영상학적 검사 및 추적 관찰을 시행해 왔다[1]. 최근 건강검진이 많이 시행되면서 증상이 없는 혈중 녹말분해효소와 지방분해효소 상승이 빈번하게 발견되고 있고 기저의 췌장질환을 배제하기 위해 소화기내과로 의뢰되는 환자가 늘고 있다. 더불어 췌장 질환이 아닌 이유로 병원에 입원하여 약물 치료 혹은 수술적 치료를 받은 환자 군 중에서 복통이 동반되거나 혹은 복통이 없는 상황에서 녹말분해효소와 지방분해효소 상승이 발견되어 감별진단을 위해 소화기내과로 협의 진료가 의뢰되는 경우도 늘어나고 있다. 따라서 본 종설에서는 고녹말분해효소혈증과 고지방분해효소혈증이 발생하는 췌장성 원인과 췌장 외 원인을 살펴보고 그러한 질환들에서 효소 상승이 발생하는 내재적 기전을 체계적으로 분석하고자 한다. 이를 통해 임상 현장에서 고녹말분해효소혈증과 고지방 분해효소혈증의 감별 진단에 대한 신속하고 합리적인 의사 결정을 도모하고자 한다.
본 론
1. 녹말분해효소 및 지방분해효소 특징
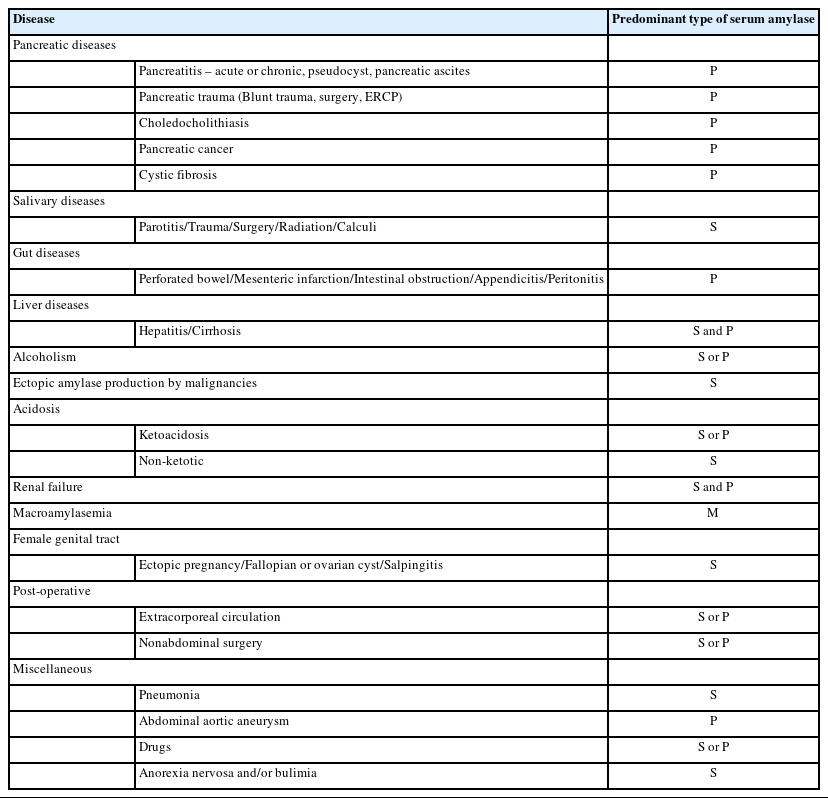
녹말분해효소는 녹말(starch) 내부의 1-4 알파 글리코사이드 결합에 작용하여 녹말을 이당류(maltose)나 올리고당류(oligosaccharides)로 가수분해하는 효소이다. α, β, γ 세 종류가 있으나 동물에서는 알파-녹말분해효소만 존재한다[2]. 녹말분해효소가 생성되는 체내 기관은 췌장, 침샘에서 대부분이 분비되고, 그 외에 악성 종양(폐, 식도, 유방, 난소), 나팔관, 폐, 갑상선, 편도, 유선 조직, 눈물샘, 땀샘, 지방조직에서도 생성된다[3]. 췌장 형의 알파 녹말분해효소(pancreatic α-amylase, P-type)는 췌장에서만 생성되고, 침샘 형의 알파녹말분해효소(salivary α-amylase, S-type)는 타장기에서도 분비될 수 있다[2]. 따라서 혈중의 녹말분해효소는 40%가 P-type이고 60%가 S-type으로 구성되어 있다[4]. 다양한 질환에서 발견되는 녹말분해효소의 종류는 pancreatic hyperamylasemia, salivary gland hyperamylasemia, mixed hyperamylasemia, macroamylasemia로 분류될 수 있다(Table 1) [3].
지방분해효소는 췌장의 선방세포에서 생성되는 또 다른 효소로 중성지방의 에스테르 결합에 작용하여 이들을 2-모노아실글리세롤(2-monoacylglycerol)과 지방산으로 가수분해하는 역할을 한다. 지방분해효소가 생성되는 체내 기관은 췌장, 간, 위, 십이지장, 대장, 심장, 혀샘(lingual gland), 지방세포가 대표적이다[5,6]. 사람이 가지고 있는 지방분해효소는 전-십이지장 지방분해효소(pre-duodenal lipase)인 혀(lingual lipase) 및 위 지방분해효소(gastric lipase)와 십이지장 외 지방분해효소(extra-duodenal lipase)인 췌장(pancreatic lipase), 간장(hepatic) , 지단백(lipoprotein lipase) 및 내피 지방분해효소(endothelial lipase)로 나눌 수 있다[7]. 이 중 췌장 지방분해효소가 전체 식이지방의 50-70%에 대한 가수분해를 담당하고 있다[8]. 따라서 췌장기능 부전이 있는 경우 타 장기에서 충분하게 지방분해효소 생산을 보상 하기 어렵기 때문에 지방소화장애가 발생한다[8]. 지방분해효소의 활성도는 녹말분해효소에 비해 4배 이상 커서 녹말분해효소 상승이 정상으로 회복된 뒤에도 지방분해효소 상승은 지속될 수 있다[4].
2. 췌장에서 생성되는 췌효소의 세포내 이동(intracellular transport of pancreatic enzymes)
췌장에서 생성되는 다양한 효소들(protease, amylase, lipase, trypsinogen, chymotrypsinogen, carboxypeptidases, esterases, glycosidase, Dnase, RNases등)은 선방세포(acinar cell) 내의 골지체 성숙면(trans-Golgi network) 안에서 분비 세포 소기관(secretory organelles)인 효소원(zymogen) 안에 과립(granule) 형태로 응축되어 비활성화 상태로 존재한다[9]. 골지체 성숙면은 골지체 구성 성분 중에서 핵과는 멀고 세포막 쪽과 가장 가까운 부위를 의미한다.
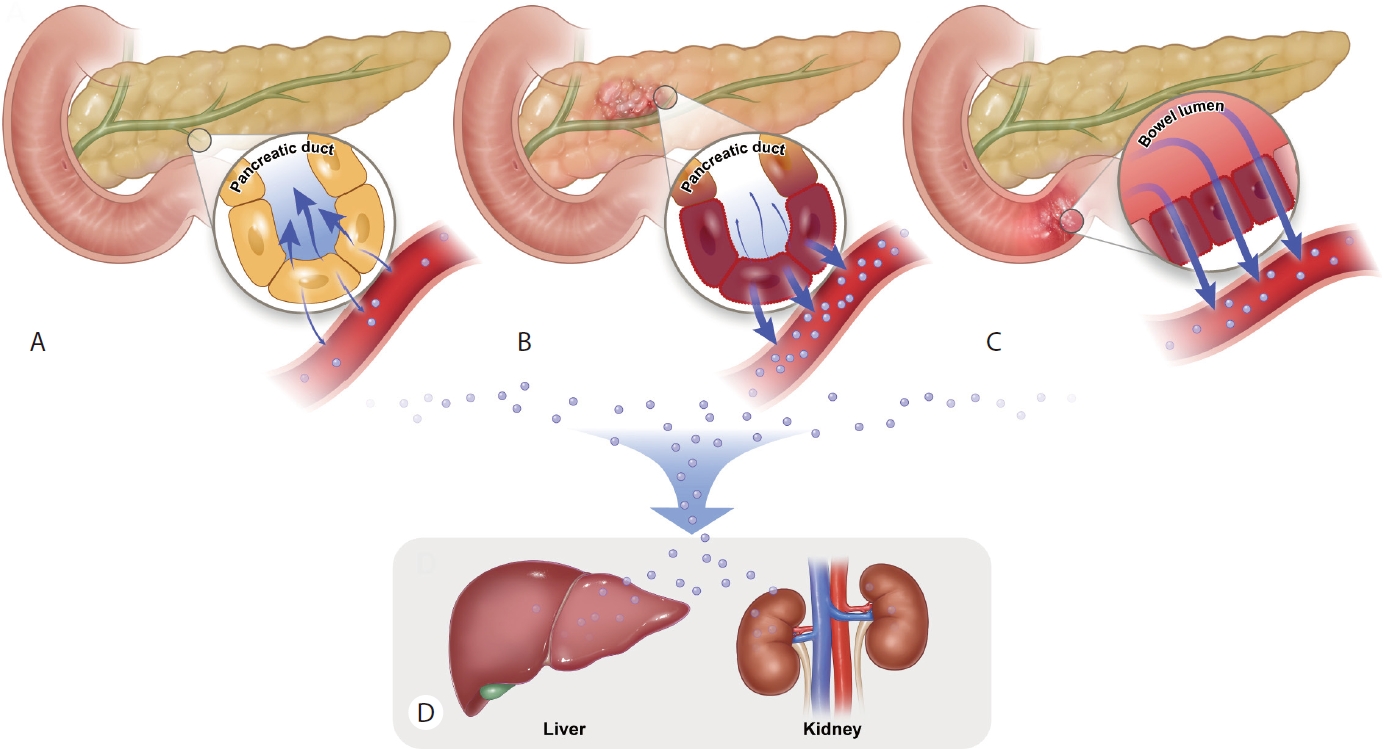
효소원 과립(zymogen granule)들은 골지체 성숙면에서 분비된 후 대다수가 선방세포의 선단막(apical membrane)을 통해 췌관으로 외분비 되어(apical exocytosis) 십이지장으로 배출된다[10]. 그러나 소량의 효소원 과립들은 정상적으로도 선방세포의 기저측면막(basolateral membrane)을 통해 췌관 방향이 아닌 간질(interstitium) 쪽으로 분비되어 림프관과 모세혈관으로 내분비된다(basolateral exocytosis) (Fig. 1A) [3,5,6,11,12]. 이에 따라 혈액 내에서 일정량의 췌효소들이 항상 측정되게 된다.
효소원 과립들은 선단막을 통해 세포 외로 유출(exocytosis) 되기 전에는 세포 내에서 단백질 분해 효소가 들어있는 세포 소기관인 리소좀(lysosome)과 상호작용을 거의 하지 않기 때문에 비활성화 상태를 유지한 채로 십이지장까지 분비된다. 효소원 과립의 일부가 세포외 유출 전에 선방세포 내에서 소량 활성화되더라도 trypsin inhibitor 등에 의해 보호되어 세포 손상이 예방되는 보호 기전이 정상적으로 존재한다[13].
그러나 췌장염 상태에서는 효소원 과립의 apical exocytosis가 방해되는 pancreastasis가 발생하기 때문에 효소원 과립의 세포 내 저류(zymogen retension)가 발생하게 된다. 저류된 효소원들이 원래는 결합하지 않아야 할 리소좀과 결합하게 되면서 리소좀 내의 cathepsin B가 효소원 과립 내의 trypsinogen을 trypsin으로 전환시키게 된다. 결국 활성화된 trypsin이 효소원 과립 내의 다른 효소들(proelastase, procarboxypeptidase등)을 연쇄적으로 활성화시켜 선방세포 손상이 발생하게 된다[13]. 이러한 세포 손상에 따라 저류된 효소원들이 차단된 선단막 대신 기저측면막을 통해 간질쪽으로 유출이 되고, 이들이 림프관과 모세혈관으로 다량 이동하게 되어 혈중 췌장효소 수치가 크게 상승하게 된다(Fig. 1B) [14].
3. 녹말분해효소 및 지방분해효소의 배설과 대사
혈중으로 들어온 녹말분해효소의 25%는 소변으로 배출이 되고, 75%는 간으로 대표되는 세망내피계(reticulo-endothelial system)에 의해 대사가 된다[7]. 그러나 투석을 하는 경우에는 녹말분해효소가 제거되지 않는다[3]. 혈중으로 들어온 지방분해효소는 신장에서 100% 재흡수 되어 소변으로는 배출되지 않으나 재흡수된 지방분해효소는 신장 안에서 거의 대부분 아미노산으로 대사되고 일부는 간, 폐, 비장에서 대사된다[15]. 따라서 배설과 대사에 문제가 있는 경우에는 췌장 질환과 상관없이 혈중 췌장효소 수치가 상승하게 된다(Fig. 1D).
4. 혈중 녹말분해효소와 지방분해효소 상승의 기전
혈중 녹말분해효소와 지방분해효소의 상승은 혈행으로 유입되는 효소와 제거되는 효소의 양적 비율에 불균형이 발생할 때 일어난다. 먼저 녹말분해효소와 지방분해효소가 혈행으로 유입되는 양이 증가되는 경우를 살펴보고자 한다. 첫 번째 기전(기전1)은 췌장의 염증이나 종양성 변화, 혹은 항진된 자율 신경의 활성화로 인해 효소를 생산하는 췌장의 분비샘이 과도한 자극(hyperstimulation)을 받아서 췌장에서 효소 생산 자체가 절대적으로 증가하는 경우가 있을 수 있다[6]. 두 번째로(기전2) 앞서 설명한 바와 같이 췌장의 염증이나 췌관의 협착으로 인해 선방 세포의 손상이 발생하고 이로 인해 선단막을 통한 효소의 외분비가 차단되고, 기저측면막을 통한 효소의 누출이 증가하는 leakage phenomenon이 대표적인 혈중 췌효소 상승의 원인이다(Fig. 1B) [3,12]. 기저측면막을 통해 간질로 유출된 효소들은 혈행으로 바로 흡수되기도 하고, 림프관을 경유하여 최종적으로 혈액으로 흡수되기도 한다. 췌장염 후에 췌장주변조직이나 복강 쪽으로 누출된 효소들도 림프관을 경유하여 종국에는 혈액으로 흡수된다[3]. 기전1이나 기전2에 의한 췌장의 변화는 주로 췌장 자체의 일차적 질환에 의해 발생하지만 췌장은 염증 반응에 민감하기 때문에 췌장 주변 타장기의 염증성 질환이 췌장으로 파급되어 이차적인 췌장 손상에 의해 발생하기도 한다.
세 번째 기전(기전3)은 장의 투과성과 연관이 있다. 정상적으로 췌관을 통해 소장으로 외분비된 췌효소는 장을 투과하지 못하기 때문에 원칙적으로 혈관으로 유입되지 못한다. 그러나 소장 점막의 barrier가 손상되는 다양한 위장의 염증성 질환이 발생한 경우에는 소장 점막의 투과성(intestinal permeability)이 증가되어 정상적으로 소장으로 외분비 되었던 췌효소들이 장 점막을 통해 흡수되고 이들이 혈중으로 유입되어 췌장 질환과 상관없이 췌효소의 혈중 농도를 증가시킬 수 있다(Fig. 1C) [3,6]. 이 경우 S-type 녹말분해효소는 위에서 위산에 의해 상당 부분 소실되기 때문에 대부분은 P-type 녹말분해효소가 주로 검출된다.
네 번째 기전(기전4)은 췌장 이외의 장기와 연관이 있다. 췌장 효소는 침샘 등 췌장 이외의 다른 장기나 폐, 식도, 유방 난소 등 이소성 종양에서도 생성되기 때문에 위에서 제시한 기전1, 기전2의 내용과 동일한 방식으로 해당 장기에서 녹말분해효소와 지방분해효소가 선단막이 아닌 기저측면막쪽으로 유출되는 양이 증가되어 췌장 외 원인으로 녹말분해효소와 지방분해효소의 혈중 농도가 증가될 수 있다[3].
위에서 설명한 바대로 효소의 혈중 유입과 무관하게 녹말분해효소와 지방분해효소의 대사청소율(metabolic clearance)에 문제가 있는 경우에도 혈중 췌효소의 상승을 유발할 수 있다(기전 5). 췌효소의 배설 경로에서 제시한 바와 같이 신장과 간(세망내피계)이 췌효소의 배설과 대사에 중요한 작용을 하기 때문에 이 장기에 질환이 발생하거나 기능저하가 발생하는 경우에는 췌장 등 녹말분해효소, 지방분해효소를 생산하는 장기의 질환과는 무관하게 혈중 녹말분해효소와 지방분해효소의 상승이 발생할 수 있다(Fig. 1D) [7].
마지막 기전(기전6)은 녹말분해효소와 지방분해효소가 면역글로불린과 복합체를 형성하여 신장으로 배설되지 못하는 것과 연관이 있다. 다양한 면역질환, 자가면역성질환, 림프증식성질환이나 종양과 관련하여 체내에 면역글로불린(주로 IgA)이 많이 생성되는 경우, 이들과 혈중녹말분해효소, 지방분해효소, 알칼리성인산가수분해효소, 아스파테이트아미노전달효소, 크레아틴키나제, 젖산탈수소효소가 결합하여 복합체를 형성할 수 있다[16]. 이를 거대효소혈증(macroenzymemia) 이라고 하고 거대녹말분해효소제혈증(macroamylasemia)이 대표적인 질환이다. 이 거대효소는 분자량이 커서 신장에서 정상적으로 여과되지 못하므로 적기에 배설 혹은 대사되지 못해, 체내에 축적되게 된다. 또한 정상 녹말분해효소보다 반감기도 길어서 혈중 녹말분해효소 농도를 오랫동안 높이게 된다. 거대녹말분해효소제혈증은 녹말분해효소 전기영동(electrophoresis) 검사 상에서 S-type과 P-type 녹말분해효소가 구별되지 않는 smeared band 형태를 보이는 것이 특징적이다. 또한 녹말분해효소의 신장 여과량이 감소되기 때문에, 24시간 소변에서 녹말분해효소 청소율 대 크레아티닌 청소율의 비율(amylase clearance:creatinine clearance ratio, CAM:CCR ratio)이 1% 미만인 경우 의심할 수 있다. 또한 큰 분자량의 단백질을 침전시키는 성질을 이용한 polyethylene glycol 침전법을 사용하여 침전되는 비율이 60% 이상일 때도 거대녹말분해효소제혈증을 의심할 수 있다. Chromatography나 ultracentrifugation을 통해 거대녹말분해효소를 직접 검출할 수도 있다.
5. 혈청 녹말분해효소와 지방분해효소 상승의 원인
녹말분해효소와 지방분해효소 상승의 주요 원인은 Table 1-4에 제시하였다. 췌장염을 비롯한 대부분의 주요 원인들은 위에서 제시된 기전 1-6으로 설명이 가능하고 일부는 여러 기전이 복합적으로 작용하는 것으로 알려져 있다. 예컨대 악성종양( 폐 , 식도, 유방, 난소)에서 혈중 녹말분해효소, 지방분해효소의 상승은 종양에 의한 효소의 과생산에서 기인하기도 하고(기전4) 종양과 연관되어 생성된 면역글로불린에 의해 발생한 거대효소혈증에 기인하기도 한다(기전6) [3,11]. 간염이 있는 경우는 녹말분해효소가 간에서 정상적으로 대사되지 못하여 효소의 청소율이 감소하는 것으로 설명이 되지만(기전5), 간염에 이차적으로 병발한 췌장 염증이 원인으로 제시되기도 한다(기전2) [6]. 음주에 의한 녹말분해효소의 상승은 주로 췌장염에 의한것으로 설명되지만(기전2), 복통이 동반되지 않은 경미한 상승은 알코올에 의한 침샘의 손상으로 설명된다(기전4) [3]. 알코올에 의한 자율신경의 기능부전은 침샘의 선방세포 내에서 효소원 과립의 세포내 저류를 유발하여 선방세포의 비대(hypertrophy) 및 지질의 침윤을 초래한다. 이에 따라 침샘 특히 양측 이하선의 반복적인 무통성 종창(painless swelling)이 발생되고, 이를 타액선증(sialoadenosis)이라고 한다. 이 경우 녹말분해효소 수치가 정상 상한치의 3배를 넘지는 않는 것으로 알려져 있다.
급성 담낭염의 경우에서도 혈중 췌효소 상승이 동반될 수 있는데 이것은 담낭염의 염증이나 투여한 약물과 연관되어 오디괄약근 수축이 유발되고 췌장염이 발생하여 나타날 수도 있고(기전2), 담낭염의 염증이 췌장으로 파급되어 발생할 수도 있다(기전2) [17]. 복통이 동반된 혈중 췌효소 상승의 경우 장경색(gut infarction)과 장천공(gut perforation)을 반드시 감별 진단에 포함시켜야 한다. 장경색에서 췌효소의 상승은 기전3에 의해 설명될 수 있고, 천공의 경우 복강 쪽으로 누출된 췌효소들이 림프관을 경유하여 종국에는 혈액으로 흡수되어 발생하게 된다. 이 경우 녹말분해효소 수치가 정상 상한치의 3배를 넘는 경우는 드물고, S-type의 녹말분해효소는 위산에 의해 파괴되기 때문에 주로 P-type의 녹말분해효소가 상승하게 된다.
당뇨병성케토산증에서는 주로 신장의 관류 감소로 인한 신장에서 효소의 배설 감소(기전5), 췌장의 관류감소 및 산증으로 인한 췌장내 세포 스트레스(cellular stress)의 증가(기전2), 면역연관성 베타세포 손상에 이차적으로 발생한 선방세포의 손상(기전2) 으로 설명될 수 있다[6,11]. 전신성홍반성루푸스의 경우에는 혈관염에 의한 루푸스 췌장염의 병발(기전2), 자가항체 생성에 따른 거대아밀라아제혈증, 거대리파아제혈증의 발현(기전6) , 면역시스템의 항진에 의한 전신 염증 반응(기전2 or 기전4)으로 설명되고 있다[18]. 스테로이드 약물 사용 후 발생하는 고녹말분해효소/지방분해효소제혈증은 스테로이드를 사용하게 된 원인인 기저 면역질환과 연관되었거나(기전6), 스테로이드가 췌장 선방세포에서 녹말분해효소 합성을 증가시키거나(기전1), 스테로이드가 직접 췌장염을 유발하는 것으로 설명된다(기전2) [19].
수술 후 췌효소가 상승되는 경우 중에서 심폐우회술을 받은 경우는 저관류성 췌장 세포 손상에 의해 현증 췌장염이 발생할 수 있다(기전2). 그러나 수술 후에는 복통이 기저에 계속 있기 때문에 비췌장성 원인에 의한 효소 상승이 급성 췌장염으로 오인되는 경우가 많다. 실제로는 수술 후 대사의 변화나 기계환기 후 경미한 침샘/폐의 손상이나 수술 후 폐의 염증에 기인하는 바가 많고(기전4) 따라서 S-type의 녹말분해효소 상승이 주로 관찰된다[3]. 또한 수술 후 신장기능저하(기전5) 및 장의 허혈과 연관되어 상승하는 경우(기전3)도 있다[20]. 두부손상으로 뇌수술을 받은 경우에는 두부손상과 연관되어 침샘과 췌장의 효소 분비를 촉진하는 부교감신경의 항진이 발생하고, cholecystokinin과 같은 pancreatic polypeptide의 증가가 발생하여 췌장염과 무관하게 효소의 상승이 나타날 수 있다(기전1) [21].
중환자실 환자들의 경우에는 불안정한 혈압으로 인한 저관류성 췌장 세포 손상, 고칼슘혈증과 연관된 췌장 세포 내 효소의 조기 활성화, 장기간 기계환기에 따른 정맥 환류의 감소(venous return) 혹은 혈관수축제 사용으로 인한 내장 허혈(splanchnic ischemia) 및 이로 인한 저관류성 췌장 손상(기전2), 수면 마취 약물 사용에 따른 고중성지방혈증의 발생 등과 연관되어 현증 췌장염(기전2)이 발생할 수도 있다. 그러나 환자의 상태에 따라 복통이나 병력 청취가 어려운 경우가 많아서 임상적인 치료가 불필요한 무증상의 췌장 기원성 효소 상승이 현증 췌장염으로 오인될 수 있고, 췌장 외 원인에 의한 췌장 효소 상승(내장 허혈이나 마비상 장폐쇄와 연관된 장허혈에 의한 효소 상승[기전3], 기계환기과 연관된 침샘의 염증에 따른 상승[기전4], 간, 신기능 저하와 연관된 효소 상승[기전5])이 췌장염으로 역시 오인될 수 있다[11,22].
6. Gullo 증후군(benign pancreatic hyperenzymemia, BPH)
혈중 췌효소(pancreatic isoamylase, lipase, trypsin)의 만성적인 상승이 있으나 증상이 없고 췌장의 기질적 질환이 없는 경우를 Gullo 증후군 혹은 BPH라고 부른다[23]. Gullo 증후군은 췌효소가 상승되어 췌효소에 대한 반복적인 추적 피검사를 시행하는 환자들의 2%를 차지하는 것으로 보고되었다[7].
Gullo 증후군은 산발성(sporadic) 혹은 가족성(familial) 형태로 나타나고 소아에서도 나타나기 때문에 유전적인 문제가 있을 것으로 추정되지만 정확한 원인은 아직 밝혀지지 않았다. 췌장 효소가 상승하게 되는 기전은 명확한 췌장 질환이 없는 상황에서 선방세포의 기저측면막을 통한 췌장효소의 혈행으로의 유출이 증가되면서 발생하는 것으로 생각되고 있다[24].
진단을 위해서는 효소 상승을 유발할 수 있는 다양한 췌장 질환 및 췌장 외 질환들이 배제되어야 하기 때문에, 영상 검사가 음성이고 적어도 1-2년의 기간 동안 췌효소의 변동이 지속되는 경우에 진단을 내릴 수 있다[1,24,25]. 췌효소 상승의 1-2%는 췌장 종양에서 기원하고 작은 췌장 낭종이나 조기 만성 췌장염, 자가면역성 췌장염, 분할췌, 오디괄약근 기능 이상 등이 초기에 진단되지 않을 개연성이 있기 때문에 진단 전에 특히 자기공명 담췌관조영술(표준적인 조영증강 혹은 secretin 자극 후)과 초음파내시경 검사가 권고된다[26]. 췌효소의 상승은 일반적으로 정상의 1.5-4배 정도 상승이 관찰되고 일중에도 변동이 있을 수 있으며, 추적관찰 중에도 많은 변동이 있고 정상 수치를 보이기도 한다[27]. 90-95%의 환자는 모든 췌효소의 상승이 관찰되고 드물게 녹말분해효소 혹은 지방분해효소만 단독으로 상승되는 경우도 있다[25].
최종적으로 Gullo 증후군이 진단되는 경우에 결과적으로는 불필요한 검사의 반복을 통해 의료비 지출이 발생한 셈이지만, 무증상의 환자를 무조건적으로 Gullo 증후군으로 결론 내리고 추가 검사와 외래 추적을 시행하지 않는 것은 오진의 위험성을 내포할 수 있다[1,24,25].
결 론
고녹말분해효소제혈증과 고지방분해효소제혈증은 췌장염의 중요한 표현형으로 널리 알려져 있지만 다른 췌장 질환 및 췌장 외 질환에서도 나타날 수 있다. 따라서 이들의 원인을 감별하고, 그 원인이 효소 상승을 유발하는 합리적인 기전을 추론하는 것은 질병의 정확한 진단과 적절한 치료 계획 수립에 매우 중요하다. 또한 무증상 환자나 타과 환자에서 췌장염의 과진단(overdiagnosis)을 예방하여 불필요한 금식, 약물 투여, 반복적인 영상 검사 및 피검사에 따른 환자의 불편감 증가, 입원 기간의 상승, 의료비 상승을 예방할 수 있다.
Notes
Conflicts of Interest
Min Jae Yang is currently serving as an Editor in Editorial Board of the Korean Journal of Pancreas and Biliary Tract; however, Min Jae Yang was not involved in the peer reviewer selection, evaluation, or decision process of this manuscript. Se Hee Lee and Woohyun Cho have no potential conflicts of interest.
Acknowledgements
This work was supported by a National Research Foundation of Korea (NRF) grant funded by the Korean government (NRF-2021R1C1C1008619).