피막형 팽창성 금속 스텐트를 삽입하여 호전된 담도 스텐트 제거 후 발생한 대량의 혈액 담즙증 2예
Two Cases of Life-Threatening Hemobilia Following Removal of Biliary Stents Treated with Covered Self-Expandable Metal Stents
Article information
Abstract
담도 스텐트가 인접한 담도 주위 혈관에 손상을 주어 혈액 담즙증을 유발하거나 스텐트 제거 시 손상으로 발생할 수 있다고 드물게 보고된다. 스텐트 제거 시 활력징후가 불안정해질 정도의 혈액 담즙증이 생기는 경우, 혈관조영술을 시행하기 전 구조 요법으로 피막형 팽창성 금속 스텐트의 압박 효과를 통한 지혈을 기대하고 삽입할 수 있다. 본 두 증례는 간문부 담관암 환자에서 간문부 폐색에 대해 삽입한 담도 스텐트 그리고 간세포암종 환자에서 간동맥 화학색전술 이후 동반된 간농양의 내배액 목적으로 삽입한 담도 스텐트를 각각 교체 목적으로 제거 후 급격히 악화된 대량의 혈액 담즙증을 피막형 팽창성 금속 스텐트를 삽입하여 성공적으로 치료된 사례이다. 한편, 해당 상황에선 정확한 출혈 위치를 알기 어려워 예상되는 출혈 위치를 포함할 수 있을 만큼 높은 위치에 스텐트를 삽입해야 하며 적절한 위치에 삽입되었더라도 지혈이 되지 않을 수 있기에 일시적인 방안이며 스텐트 자체의 한계점들도 있다. 따라서, 기존의 스텐트 제거 시 혈액 담즙증이 발생할 수 있음을 인지하고, 그중 출혈의 위험성이 높은 환자에서는 제거 전 영상 검사를 고려해야 하며 출혈이 발생한 뒤 스텐트를 통해 성공적으로 지혈을 시행했더라도 출혈 및 가성동맥류와 같은 혈관 기형의 확인을 위한 영상 검사를 고려해야한다.
Trans Abstract
Biliary stent removal can cause hemobilia due to injury to the adjacent vessel, but it is rarely reported. If significant hemobilia occurs during stent removal, samesession covered self-expandable metal stent (CSEMS) insertion may be useful as a rescue or bridge therapy before angiography. Here, we report two cases of lifethreatening hemobilia following stent removal successfully treated by CSEMS. The first case was a Klatskin tumor bismuth type IV patient who required biliary stenting for resolving malignant biliary obstruction. The second case was a hepatocellular carcinoma patient who had undergone multiple transarterial chemoembolization and required biliary stents for liver abscess. In this situation, inserting a CSEMS at a higher level than the expected bleeding site and recognizing stenting as a temporary therapy with its limitations are important. Also, it is crucial to consider pre-procedural imaging in high-risk patients, and perform post-procedural imaging to evaluate for ongoing bleeding or vascular abnormalities.
서 론
혈액 담즙증은 혈관과 담도 사이의 연결로 인해 담도계에서 일어나는 출혈로, 진단이 어렵고 치료가 늦어지면 치명적일 수 있다. 최근 혈액 담즙증은 간 및 담관 관련 시술에 의한 의인성 손상이 주요 원인이 되고 있고, 담도 스텐트가 인접한 담도 주위 혈관에 장기간 혹은 반복적인 손상을 주어 혈액 담즙증을 유발하거나 스텐트 제거 시 손상으로 발생할 수 있다고 보고된 바 있다[1]. 내시경을 통한 담도 스텐트 제거 후 활력징후가 불안정해질 정도로 대량의 혈액 담즙증이 생기는 경우가 있는데, 가장 효과적이라고 널리 인정되고 있는 치료는 충분한 초기 소생술을 하면서 혈관조영술을 시행하여 출혈 병소를 찾아 색전술을 시행하는 것이다[1,2]. 하지만 실제 임상현장에서는 혈관조영술 및 색전술을 바로 시행하는 것이 불가능한 경우가 많고, 그 기간 동안 환자들은 급격한 임상적 악화를 겪고 치명적인 상태에 놓이기도 한다.
저자들은 간문부 담관암 환자에서 간문부 폐색에 대해 삽입한 담도 스텐트와 간세포암종 환자에서 간동맥 화학색전술 이후 동반된 간농양의 내배액 목적으로 삽입한 담도 스텐트를 각각 교체 목적으로 제거 후 급격히 발생한 대량의 혈액 담즙증을 피막형 팽창성 금속 스텐트를 삽입하여 내시경적 지혈술에 성공한 2예를 경험하였기에 보고하는 바이다.
증 례
1. 증례 1
74세 남자가 1주일 전부터 황달 증상이 있고 1일 전부터 열이 동반되어 내원하였다. 간문부 담관암으로 항암 치료를 하고 있고, Bismuth type IV 간문부 협착으로 플라스틱 스텐트를 정기적으로 교체하던 중 4개월 전 우측의 간내담도에 Y자 형태로 전체 피막형 팽창성 금속 스텐트를 거치했다. 기저 질환으로 고혈압, 당뇨, 고지혈증이 있었고, 가족력 및 사회력은 특이 소견이 없었다.
진찰상 급성 병색을 보였으나 의식은 명료하였다. 활력 징후는 혈압 148/94 mmHg, 맥박수 98회/분, 호흡수 16회/분, 체온 38.6°C였다. 신체 검사에서 복부는 부드러우나 약간의 압통이 있었고, 결막이 황색으로 관찰됐다. 말초혈액검사에서 백혈구 8,200/mm3, 혈색소 10.9 g/dL, 혈소판 213,000/mm3였다. 혈청생화학검사에서 아스파트산아미노기전달효소 56 IU/L, 알라닌아미노기전달효소 72 IU/L, 알칼리성인산염분해효소 297 U/L, 총빌리루빈 4.6 mg/dL였다.
신체 검사와 혈액 검사 결과를 종합했을 때 이전에 삽입한 담도 스텐트의 기능 장애로 인한 폐쇄성 담관염으로 진단하고 내시경역행담도조영술을 시행하였다. 이전에 삽입한 두 개의 금속 스텐트가 막혀 있어 스텐트 교체를 위해 하나의 스텐트를 제거하였을 때, 대량의 혈액 담즙증이 발생하면서 수축기 혈압이 133 mmHg에서 40 mmHg로 감소하며 저혈량성 쇼크로 진행하였다(Fig. 1). 이에 수액 정주를 통한 초기 소생술과 함께 승압제를 투여하였다. 담도의 출혈 위치를 명확히 찾을 수 없는 상태로 나머지 하나의 스텐트를 추가로 제거한 뒤 각각 6 mm×14 cm, 6 mm×12 cm의 전체 피막형 팽창성 금속 스텐트(Niti-S Biliary stent; TaeWoong Medical Co, Ltd, Seoul, Korea)를 기존의 스텐트들과 동일한 위치에 Y자 형태로 삽입하였다(Fig. 2). 이후 활력징후는 안정화되었고, 응급으로 복부컴퓨터단층촬영을 시행하여 혈관조영술 및 색전술 필요성에 대해 평가하였으나 활동성 출혈 및 가성동맥류는 관찰되지 않았다(Fig. 3). 금속 스텐트를 삽입한 후 5일째에 추가 합병증 없이 퇴원하여 안정적으로 외래 추적관찰 하였다.
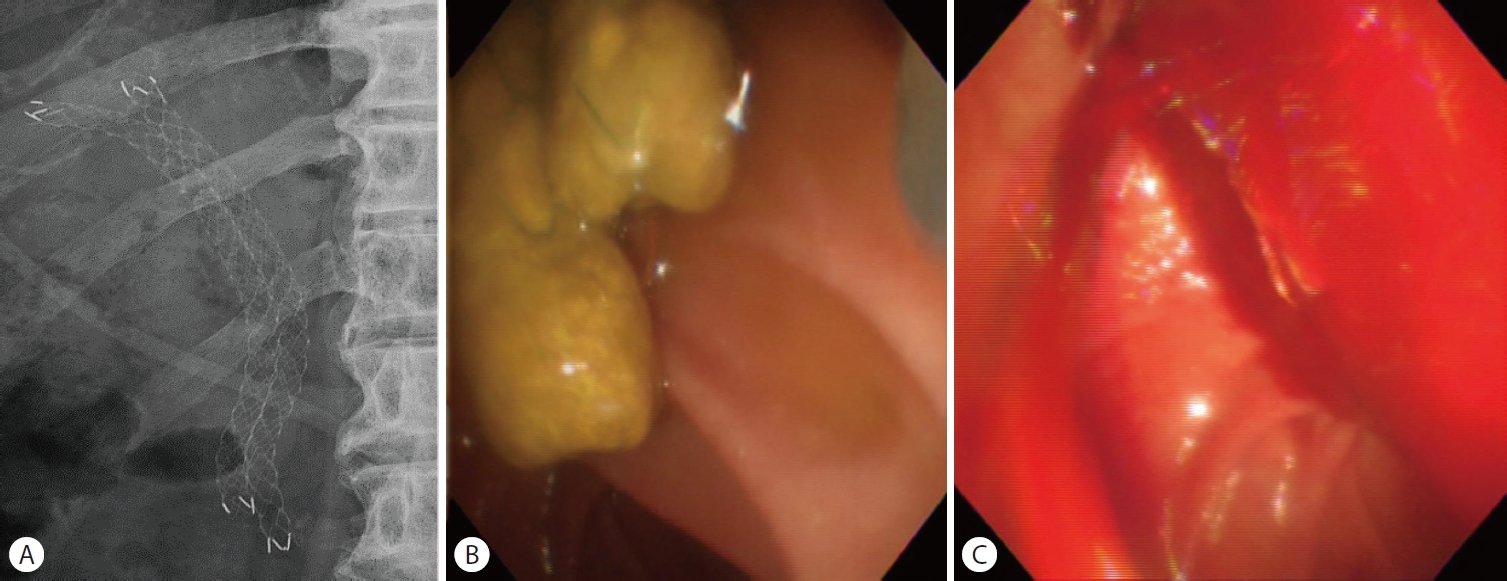
First case with hemobilia. (A) Endoscopic retrograde cholangiography shows previously inserted bilateral fully covered self-expandable metal stents (side-by-side). (B) Previously inserted stents were clogged. (C) After stents were removed, massive hemobilia was observed from the ampulla of Vater.
Endoscopic management of the first case. (A) Bile duct cannulation was done, and bilateral guidewire was placed quickly. (B) Finally, fully covered self-expandable metal stents were placed. (C) Bleeding subsided.
2. 증례 2
72세 남자가 12시간 전부터 지속되는 상복부 통증으로 본원 응급실을 방문하였다. 이전에 우측 간엽 S8 부위의 간세포 암종을 진단받아 간동맥 화학색전술을 반복해서 받았고, 10개월 전 시술 이후 우측 간엽 S8 부위에 간농양이 생겨 7 Fr, 15 cm 크기의 양쪽 돼지꼬리형 스텐트 삽입으로 내배액을 시행했었다. 4개월 전에 마지막으로 7 Fr, 15 cm 크기의 양쪽 돼지꼬리형 스텐트를 추가로 삽입했었다. 기저 질환으로 고혈압, 당뇨, 경동맥 협착증이 있었고, 가족력 및 사회력은 특이 소견이 없었다.
병원을 방문하였을 때 급성병색을 보였으나 의식은 명료하였다. 활력징후는 혈압 125/60 mmHg, 맥박수 90회/분, 호흡수 15회/분, 체온 36.5°C였다. 신체 검사에서 복부는 부드러우나 약간의 압통이 있었고, 결막이 황색으로 관찰됐다. 말초혈액검사에서 백혈구 9,690/mm3, 혈색소 9.9 g/dL, 혈소판 278,000/mm3였다. 혈청생화학검사에서 아스파트산아미노기 전달효소 72 IU/L, 알라닌아미노기전달효소 107 IU/L, 알칼리성인산염분해효소 214 U/L, 감마글루탐산탈수효소 571 U/L, 총빌리루빈 3.1 mg/dL였다.
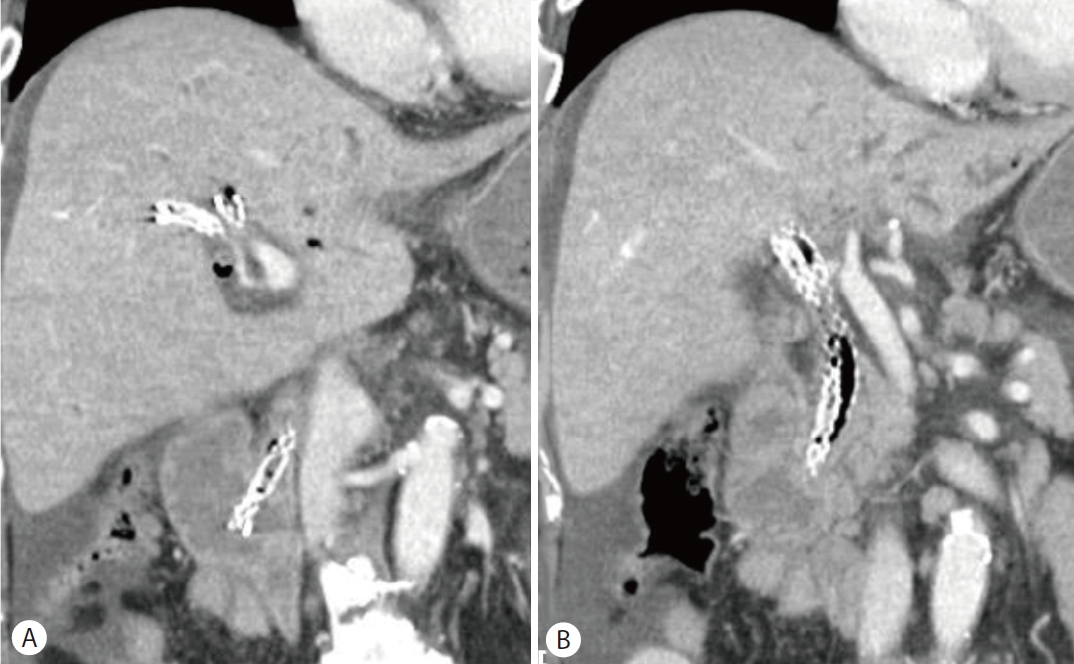
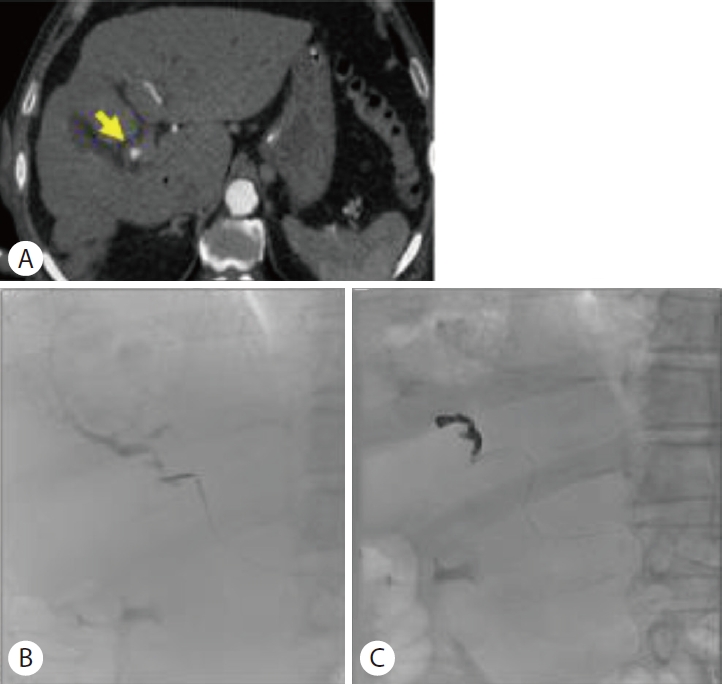
복부 전산화단층촬영에서 간농양은 큰 변화 없이 관찰되었고 스텐트의 기능장애로 진단하고 내시경역행담도조영술을 시행하였다(Fig. 4, 5A). 이전에 삽입한 두 개의 플라스틱 스텐트가 막혀 있어 스텐트 교체를 위해 제거하였다(Fig. 5B). 그러나 스텐트를 제거하자마자 대량의 혈액 담즙증이 관찰되면서 수축기 혈압이 129 mmHg에서 93 mmHg로 감소하였고, 승압제 투여 없이 수액 정주를 통한 초기 소생술을 시행하였다(Fig. 5C). 출혈의 위치를 명확히 찾을 수 없는 상태였지만 간세포암과 간농양 부위에서 출혈 가능성이 있었고, 담도 삽관 후 6 mm×14 cm 전체 피막형 팽창성 금속 스텐트(Niti-S Biliary stent)를 삽입하였다(Fig. 6A). 이후 활력 징후는 안정화되었고, 응급으로 복부전산화단층촬영을 시행하여 혈관조영술 및 색전술 필요성에 대해 평가하였으나 활동성 출혈 및 가성동맥류는 관찰되지 않았다(Fig. 6B, C). 금속 스텐트 삽입한 후 3일째에 추가 합병증 없이 퇴원하였다.
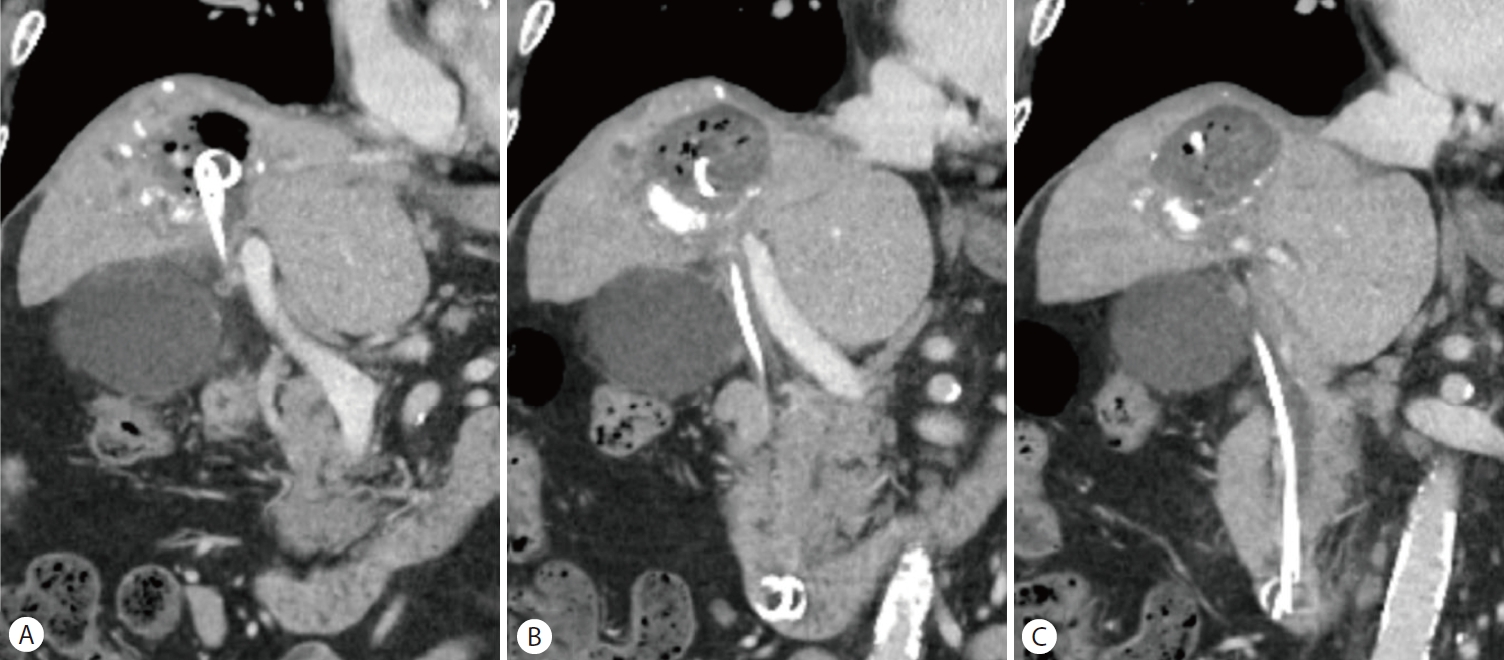
Second case. (A-C) Initial enhanced computed tomography shows persistent liver abscess in segment 8 suggesting dysfunction of previously inserted plastic stents.
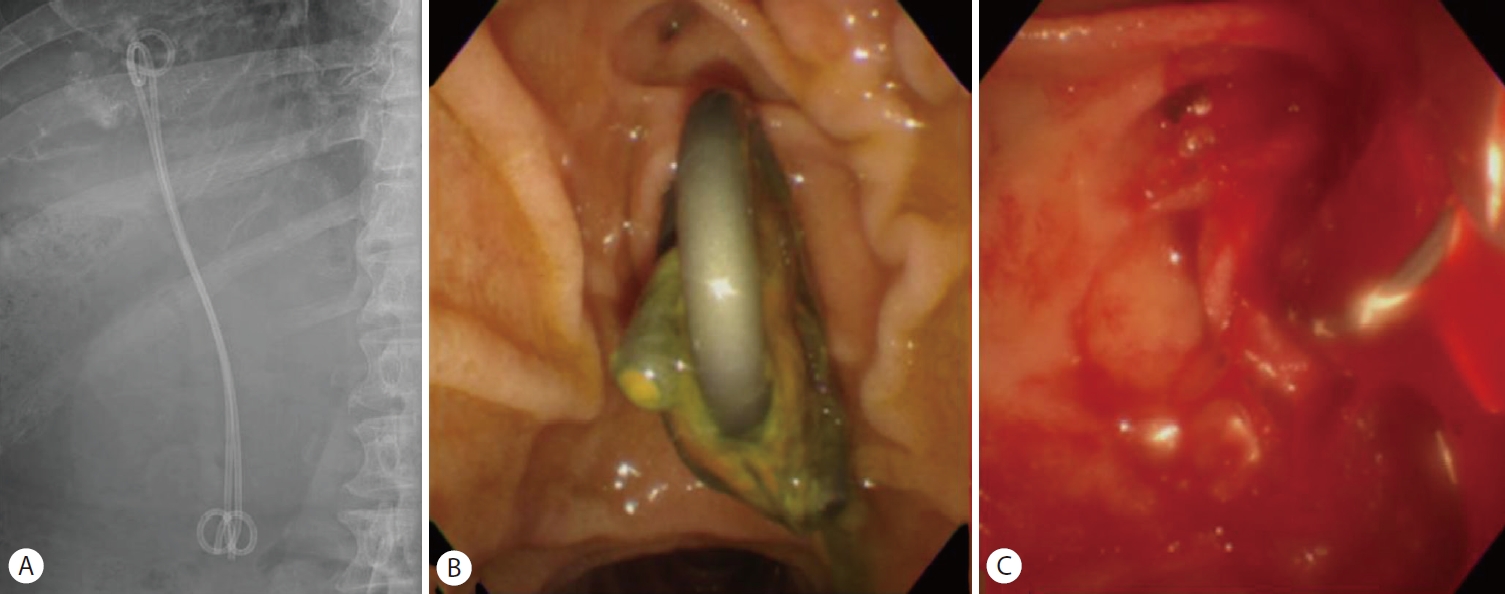
Second case with hemobilia. (A) Previously inserted plastic stents are in place. (B) When endoscopic retrograde cholangiography was performed, the lumina of plastic stents were clogged. (C) After stents were removed, large amounts of blood was released from the ampulla of Vater into the duodenum, which is consistent with hemobilia.
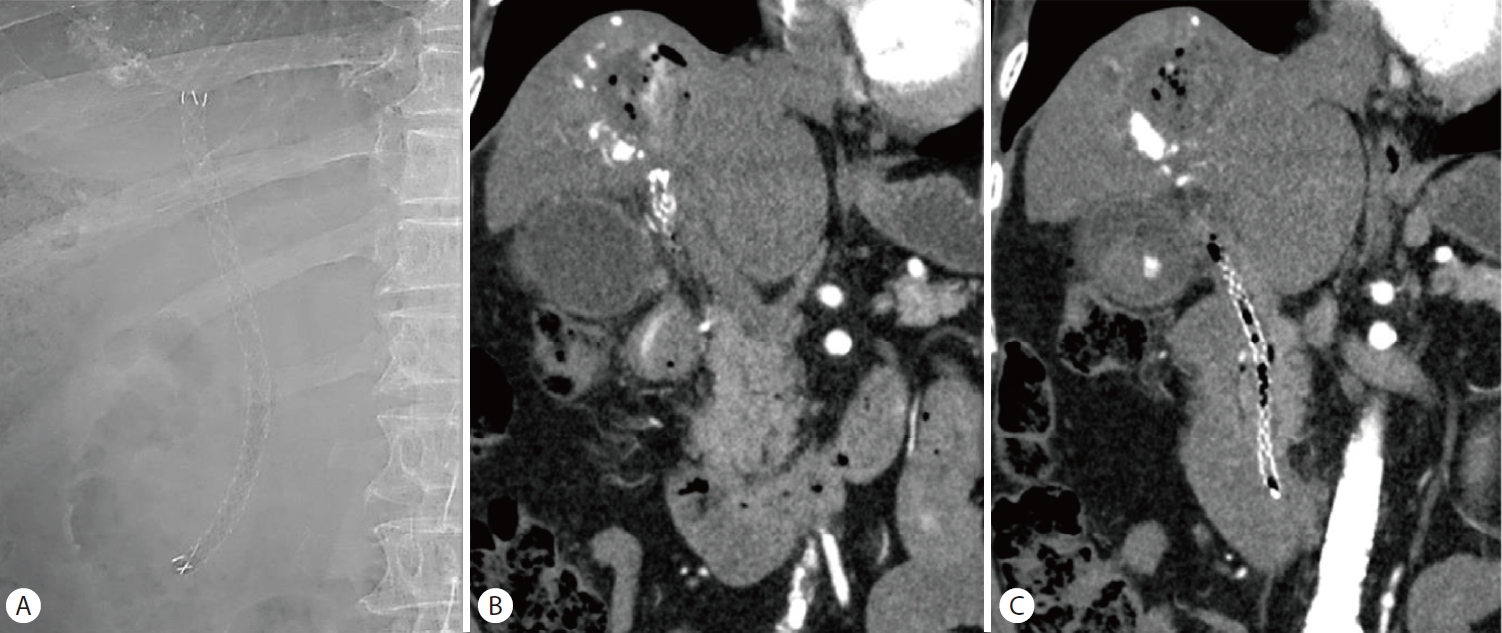
Second case after endoscopic placement (A) A fully covered self-expandable metal stent was placed. (B, C) Follow-up abdominal computed tomography shows the stent to be in place and no definite evidence of active bleeding.
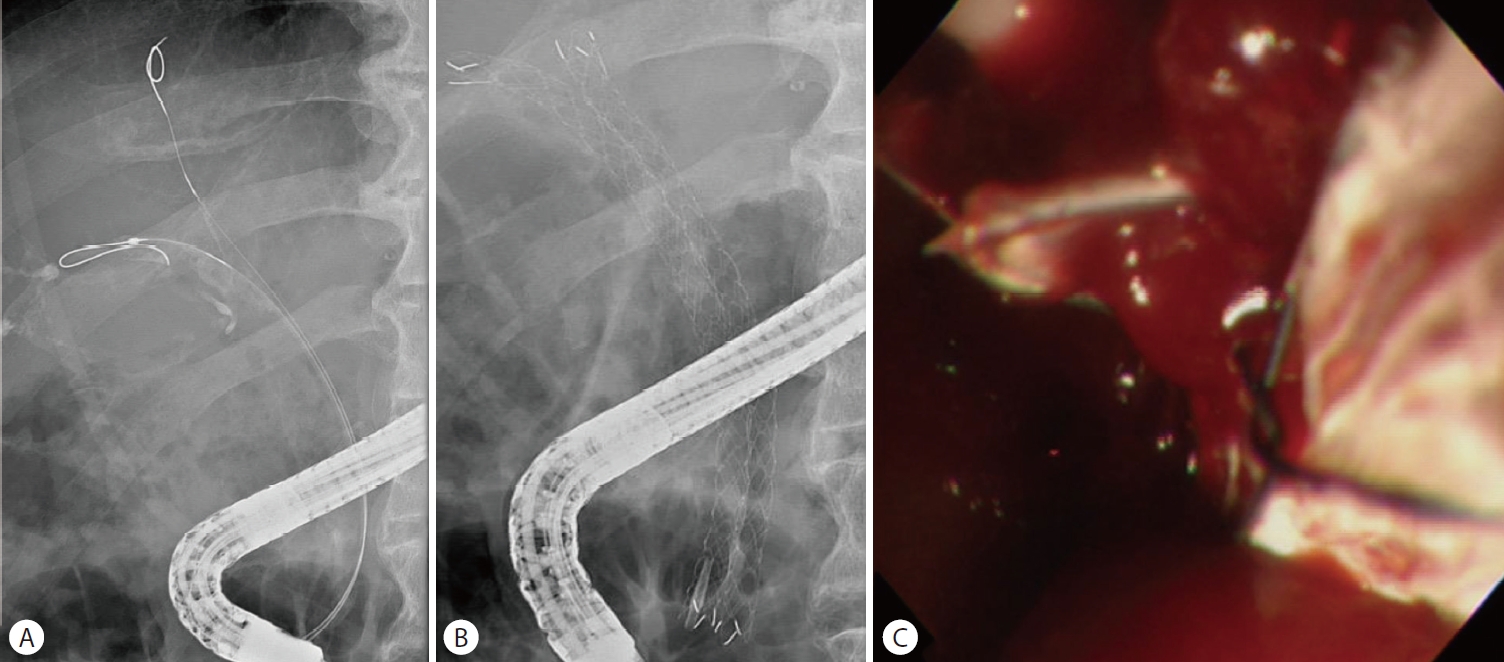
퇴원 5주 뒤 시행한 복부전산화단층촬영에서 이전에 삽입한 금속 스텐트가 자발적으로 제거된 소견이 있었으나 혈색소가 11.6 g/dL로 측정되고 출혈 소견은 없었다. 10일 뒤 다량의 흑색변이 지속되어 본원 응급실을 방문하였고, 혈압은 119/56 mmHg, 맥박수 87회/분으로 안정적이었다. 말초혈액검사에서 혈색소 7.7 g/dL로 측정되었으며, 시행한 복부전산화단층 촬영에서 오른쪽 간동맥에 가성동맥류와 혈액 담즙증 소견이 관찰되었다(Fig. 7A). 이후 혈관조영술을 시행하여 오른쪽 간동맥 가성동맥류에 마이크로코일을 이용한 색전술을 시행하였다(Fig. 7B, C). 한편, 출혈 이후 응고되는 과정에서 폐쇄성 담관염이 생길 수 있기에 담관배액을 위해 경피경간담관배액술을 시행하였고 10일째에 추가 합병증 없이 퇴원하였다.
고 찰
혈액 담즙증은 최근 내시경역행담췌관조영술, 경피적 담즙배액술을 포함한 시술들의 빈도가 증가하면서 약 50%는 의인성으로 생긴다고 알려져 있다[3]. 출혈은 빈혈의 악화와 활력 징후의 변화를 일으킬 수 있고, 추후 응고 과정을 통해 폐쇄성 담관염이 생길 수 있다. 혈액 담즙증의 치료 목표는 성공적인 지혈과 피덩이로 인해 담도가 막히지 않고 원활한 흐름을 유지하도록 하는 것이다. 치료 방법 선정에는 출혈량과 활력 징후가 중요하고, 혈액 담즙증이 생긴 원인 중 동맥류, 가성동맥류 및 누공과 같은 혈관 합병증 유무에 대한 사전 파악이 중요하다. 만일 활력 징후가 불안정하거나 혈관 합병증이 있다면 혈관조영술의 시행이 가장 보편적으로 알려진 치료라 할 수 있다[3]. 다만, 활력징후가 불안정하더라도 혈관조영술을 즉시 시행하는 것이 어려운 경우가 많고 규모가 작은 병원에서는 시행 자체가 불가하기에 그 기간동안 환자들은 급격한 임상적 악화를 겪고 치명적인 상태에 놓이기도 한다.
혈액 담즙증의 내시경적 치료는 보통 활력 징후가 안정적이면서 출혈 병소가 명확하지 않거나 초기 영상 검사에서 혈관 합병증이 보이지 않은 경우에 시행하게 되며, 주사침을 이용한 주입법, 열응고술을 이용한 방법, 압박이나 클립 등을 이용한 기계적 방법이 있다. 다만, 해당 치료들은 출혈 병소가 바터팽대부, 유두부와 같이 원위부일 때 성공적이며 대부분의 연구도 내시경 유두부괄약근 절개술이 원인인 원위부에서의 출혈에 대해서 이루어졌다[4]. 한편, 유두부 상방의 근위부 출혈에선 피막형 팽창성 금속 스텐트의 압박 효과를 통한 지혈을 기대하고 삽입할 수 있다고 드물게 보고되고 있다[5-14].
지금까지 문헌에 보고된 출혈 병소가 유두부 상방인 혈액 담즙증에서 지혈을 위해 금속 스텐트를 삽입한 경우는 10예가 있었다(Table 1). 10예 중 혈액 담즙증의 유발 요인이 암인 경우가 5예, 이전에 삽입된 스텐트의 제거인 경우가 4예, 초음파내시경 유도하 세침 흡입술인 경우가 1예 있었다. 스텐트 삽입 위치가 간문부 담관인 경우가 3예이고, 나머지 7예는 원위부 간외담관에 삽입하였다. 삽입한 스텐트의 종류는 전체 피막형 팽창성 금속 스텐트가 7예, 부분 피막형 팽창성 금속 스텐트가 2예, 비피막형 팽창성 금속 스텐트가 1예 있었다. 모든 증례에서 스텐트 삽입 직후 성공적으로 지혈되어 추가적으로 혈관조영술을 시행하지 않았다. 한편, 전체 피막형 팽창성 금속 스텐트를 삽입한 1예에서 스텐트가 자발적으로 이탈되어 2달 뒤 같은 스텐트를 다시 삽입한 것을 제외한 나머지 증례에서는 합병증이 발견되지 않았다.
다만, 간문부 담관에 지혈을 위해 피막형 팽창성 금속 스텐트를 삽입하게 되면 반대쪽 담도 폐색을 일으켜 담관염 합병증 가능성이 높고, 담도 스텐트 삽입 후 가성동맥류가 생긴 보고들이 있어 주의가 필요하다[15]. 또한, 담도 스텐트를 추후 제거해야 하는 불편함이 있고 이탈의 위험도 높으며 이로 인한 재출혈이 생길 수 있다. 조사한 문헌에서 스텐트 삽입 위치가 간문부 담관인 3예 중 2예에서 전체 피막형 팽창성 금속 스텐트를 삽입하였다. Kawaguchi 등[8]의 증례에선 혈관조영술을 통한 색전술 시행이 어려운 상황에서 출혈이 지속됐고 환자가 말기 암환자이기에 전체 피막형 팽창성 금속 스텐트를 삽입했으나 추후 담관염은 생기지 않았고, So 등[11]의 증례에선 담관염에 대한 우려로 간내담관에 플라스틱 스텐트를 추가로 삽입하였다.
본 증례와 같이 기존의 담도 스텐트를 제거하고 생긴 혈액 담즙증으로 저혈량성 쇼크가 동반되었을 때는 혈관 조영술을 이용한 색전술을 고려하기 전 구조 요법으로 도움이 될 수 있다. 다만, 출혈이 지속되어 시야 확보가 어려운 상황에서 담관 삽관을 시행할 수 있어야 하며 유도철사가 빠질 경우 재삽관이 어려울 수 있어 유도철사를 잘 유지시키는 것이 중요하다. 또한, 해당 상황에서는 정확한 출혈 위치를 알기 어렵기 때문에 예상되는 출혈 위치를 포함할 수 있을 만큼 높은 위치에 스텐트 삽입을 시행해야 한다. 이때, 간문부 담관에 지혈을 위해 피막형 팽창성 금속 스텐트를 삽입할 때에는 앞서 언급한 바와 같이 반대쪽 담도 폐색을 일으킬 수 있기 때문에 어느 정도의 간 용적을 배액 할지도 함께 고려해야한다.
한편, 적절한 위치에 스텐트가 삽입되었더라도 지혈이 되지 않을 수 있기 때문에 일시적인 방안이라는 한계가 있다. 만약 출혈이 발생한 뒤 스텐트를 통해 성공적으로 지혈을 시행했더라도 출혈 및 혈관 기형의 확인을 위한 영상 검사를 고려해야한다. 또한, 스텐트 제거 후 출혈의 위험성이 높다고 생각되는 환자들을 미리 인지하고 출혈을 예방하기 위해 노력하는 것이 필요하다. 우선, 스텐트 거치 기간이 길었는지, 출혈이 잘 일어나게 하는 동반질환이 있는지와 담도에 허혈성 손상을 유발할 만한 병력이나 치료력이 있는지를 파악한다. 출혈 위험성이 높다고 생각되는 환자들에게 교정 가능한 출혈 경향이 있다면 수혈이나 약물 투여 혹은 복용 약제 중단 등을 통해 교정하고, 스텐트 제거 전 영상 검사를 통해 주변 연관 구조물에 대한 파악을 한 뒤 더욱 주의를 기울여서 부드럽게 스텐트를 제거하는 것이 필요하다. 다만, 담도 스텐트를 제거한 후 유두부 상방에서 생긴 혈액 담즙증의 위험인자 및 치료에 대해선 아직 증례 보고 수준의 연구만 진행되어 근거가 부족한 상황이기에 추후에 대규모의 후향적 연구가 필요한 상황이다.
본 두 증례는 담도 스텐트가 인접한 담도 주위 혈관에 손상을 주었거나, 스텐트를 제거할 때 스텐트 자체에 의한 손상으로 유두부 상방의 근위부에서 혈액 담즙증이 발생한 것으로 추정된다.
결국 담도 스텐트가 인접한 담도 주위 혈관에 손상을 주거나 제거할 때 스텐트 자체에 의한 손상으로 혈액 담즙증이 발생할 수 있음을 주지하는 것이 필요하다. 따라서, 스텐트 교체가 필요한 경우 복부전산화단층촬영 등의 사전 검사를 통해 주변 연관 구조물을 파악하고 새로운 합병증 발생 유무에 대한 확인이 필요하다. 스텐트 교체 시 합병증으로 활력 징후가 불안정해질 정도의 혈액 담즙증이 발생한다면 피막형 팽창성 금속 스텐트의 압박 효과를 통한 지혈을 기대하고 삽입할 수 있다. 다만, 스텐트 삽입 시 고려해야할 점과 한계점에 대한 인지가 필요하며 성공적인 지혈 이후에도 환자 상태를 고려하여 혈관 조영술 및 색전술이 필요할지 평가가 필요할 수 있다.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.