비알코올 지방췌장질환의 최신 지견
Nonalcoholic Fatty Pancreas Disease
Article information
Abstract
비알코올 지방췌장질환은 최근 관심 받고 있는 질환 중 하나로 비만 및 대사증후군과 연관된 췌장 지방축적으로 정의된다. 진단은 주로 영상학적 검사로 이루어지나 아직까지 명확한 표준 검사법은 확립되어 있지 않은 상태이다. 임상적 결과로써 대사증후군, 2형 당뇨병, 췌장 외분비 기능 부전, 급성 췌장염, 췌장 누공, 췌장암 및 비알코올 지방간질환 등과의 연관성이 보고되고 있다. 치료는 비알코올성 지방간질환과 비슷하게 식이요법과 체중 감량 및 운동을 통하여 췌장 지방축적을 최소화하는 전략이 도움이 될 수 있다.
Trans Abstract
Nonalcoholic fatty pancreas disease (NAFPD) is a condition characterized by the accumulation of excess fat in the pancreas, commonly occurring in individuals with obesity. The diagnostic evaluation of NAFPD is mostly composed of image tests, but it is still less standardized. NAFPD is closely linked to metabolic syndrome, type 2 diabetes, pancreatic exocrine insufficiency, acute pancreatitis, pancreatic fistula, pancreatic cancer, and nonalcoholic fatty liver disease (NAFLD). However, further research is needed to investigate the mechanisms underlying these relevant clinical consequences. In terms of treatment, strategies aimed at minimizing pancreatic fat accumulation through dietary modifications and regular exercise, similar to the management of NAFLD, may be beneficial.
서 론
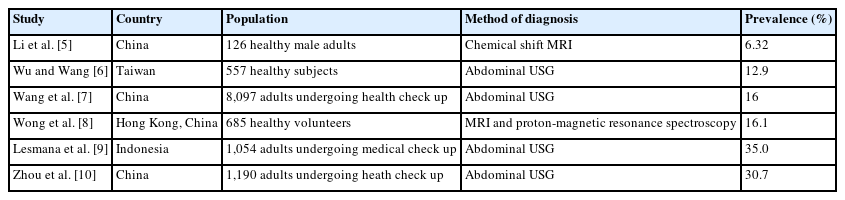
최근 전 세계적으로 비만의 비율이 증가하고 있고 우리나라에서도 꾸준히 비만인구가 증가하고 있다. 비만은 대사증후군(metabolic syndrome), 심혈관 및 뇌혈관 질환, 악성 종양 등을 포함한 다양한 건강과 연관된 문제들을 유발할 수 있다. 그중에서 비알코올 지방간질환(nonalcoholic fatty liver disease, NAFLD)의 경우 지속적으로 진행되면 비알코올 지방간염(nonalcoholic steatohepatitis, NASH)을 유발할 수 있고, 이는 간경화 및 간암으로 연결될 수 있어서 이전부터 많은 관심과 함께 현재까지 광범위하게 연구가 진행되고 있는 실정이다[1]. 이에 비해서 비알코올 지방췌장질환(nonalcoholic fatty pancreas disease, NAFPD)은 최근 몇년동안 점점 더 많은 관심을 받고 있는 새로운 질환 중 하나로 , ‘비만 및 대사증후군과 연관된 췌장 지방축적’으로 정의된다(Table 1) [2]. 췌장 지방증(pancreatic steatosis)의 개념은 1933년 Ogilvie [3]에 의해 처음 기술되었고, Stamm [4]는 췌장 내 25% 이상의 지방 함량이 2형 당뇨병, 죽상경화증(atherosclerosis) 발병의 위험과 유의한 연관관계가 있음을 보고 하였다. 비록 아직까지 표준화된 선별검사나 점수 평가법이 없어 역학 자료가 많진 않지만 비알코올 지방췌장질환의 유병률은 아시아인에서 16-35%로 보고되고 있다(Table 2) [5-10]. 최근 다양한 영상학적 검사들의 발달로 췌장 지방축적을 보다 쉽게 확인할 수 있게 되었고, 임상적으로는 대사증후군, 2형 당뇨병, 췌장염 등의 다양한 위험인자로써 비알코올 지방췌장질환에 대한 더 큰 인식이 필요할 것으로 판단되어 기존 여러 문헌들을 고찰하여 이에 대해서 자세히 알아보고자 한다.
본 론
1. 위험인자와 발병기전
최근까지 비알코올 지방췌장질환의 여러 위험인자들이 확인되었는데 그 중 비만이 가장 중요한 요인으로 받아들여지고 있다. 비만 상태에서 췌장 지방축적은 기본적으로 다음과 같은 두 가지 기전에 의해서 발생한다. 첫 번째는 죽은 꽈리세포(acinar cell)가 지방세포(adipocyte)로 대체되는 지방대체(fat replacement)이고, 두 번째는 지방침윤(fat infiltration)에 의한 지방축적이다[2,11]. 그 밖의 위험인자들로는 고령, 남성, 비알코올 지방간질환, 고혈압, 고중성지방혈증, 고혈당 등이 있다[7,12].
비알코올 지방췌장질환에 대한 발병기전은 아직까지 명확히 밝혀지지 않았지만 한 문헌보고에서는 다음과 같이 병태 생리학적 기전을 제안하였다. 먼저 비만과 2형 당뇨병과 같은 인슐린 저항성 환경에서는 지방세포의 유리지방산(free fatty acid) 분비가 증가되어 간과 췌장으로의 유리지방산 이동이 증가되며, 이러한 유리지방산은 간에서 비알코올 지방간질환의 발병을 촉진하고 초저밀도지단백질(very low density lipoprotein, VLDL)의 생성을 증가시켜 췌장으로의 지방산 전달을 증가시킨다[13]. 또한, 지방세포는 췌장의 지방축적을 촉진하는 lipocalin-2와 같은 물질을 분비하고, 비알코올 지방간질환의 발병은 fetuin의 분비를 증가시켜 췌장의 지방축적을 촉진한다[13]. 마지막으로 비만, 대사증후군 및 2형 당뇨병에서 관찰되는 염증과 산화 스트레스의 증가는 serine/threonine protein kinase 25 (STK25) 경로를 통해 간과 췌장의 지방축적을 증가시키고, 이는 췌장 베타세포의 지방독성(lipotoxicity)을 유발하여 인슐린 분비를 감소시킴으로써 고혈당을 촉진시켜 대사증후군 및 비알코올 지방췌장질환을 더욱 악화시키는 악순환을 만들게 된다(Fig. 1) [13]. 하지만 이러한 발병기전에 대해서는 추후 더 많은 연구가 필요하리라 판단된다.

Proposed pathophysiologic mechanisms of nonalcoholic fatty pancreas disease [13]. NAFPD, nonalcoholic fatty pancreas disease; NAFLD, nonalcohlic fatty liver disease; T2DM, type 2 diabetes mellitus; FFA, free fatty acid; SKT25, serine/threonine protein kinase 25; VLDL, very low density lipoprotein.
2. 진단
비록 비알코올 지방췌장질환의 진단을 위해서 다양한 검사법들이 있지만, 각각의 진단 방법에 따른 제한점으로 인하여 현재까지 명확한 표준 검사법은 확립되어 있지 않은 상태이다. 비알코올 지방췌장질환의 주요한 특징이 췌장 지방축적이므로 조직학적 생검이 진단을 위한 최적의 표준검사이기는 하나 침습적 검사라는 제한점이 있다. 따라서 실제 임상에서는 복부 초음파, 내시경 초음파(endoscopic ultrasound, EUS), 컴퓨터 단층촬영(computed tomography, CT), 자기공명영상(magnetic resonance imaging, MRI)과 같은 비침습적 진단법들이 더 적절하다고 할 수 있다. 각각의 영상검사들에 대한 특징 및 제한점들은 Table 3에 정리하였다.
1) 조직학적 생검
비알코올 지방췌장질환은 조직학적 생검을 통하여 췌장의 지방 함량을 확인할 수 있다(Fig. 2) [14,15]. 한 문헌보고에 따르면 정상 췌장조직과 지방이 축적된 췌장조직을 구별하기 위한 메타분석(meta-analysis) 결과 6.2%의 결정점(cut-off point)을 제안하였으나[16], 이 수치를 진단적 기준으로 결정하기에는 더 많은 연구가 필요하다. 또한, 췌장의 지방축적은 균일하게 이루어지지 않으며, 침습적인 검사 방법은 실제 임상에서 적용하기에는 적합하지 않다.

Histological finding of nonalcoholic fatty pancreas disease [15]. Histological examination shows many peripancreatic (A, arrowhead) and interlobular adipocytes (B, arrow) with an increase in intralobular intracellular lipid droplets (C, arrowhead), accounting for 23% of the total, indicating fatty pancreas (Hematoxylin and eosin stain, original magnification, A, ×20; B, ×50; C, ×630).
2) 복부 초음파와 내시경 초음파
복부 초음파는 저렴한 비용과 낮은 위험성으로 임상적으로 유용하게 사용될 수 있는 검사 방법이지만 위장관 내부의 가스로 인하여 췌장의 일부분 만을 확인할 수 있고, 특히나 비만 환자에서 복부 초음파를 통한 췌장의 정확한 검사는 어렵다[17]. 이와 비교해서 내시경 초음파는 췌장을 보다 정확히 확인할 수 있고 조직학적 검사 및 탄성도를 측정할 수 있는 장점이 있다[18]. 초음파 검사에서 지방이 축적된 췌장은 간과 신장에 비하여 고에코성으로 관찰되지만, 췌장 섬유증도 고에코성으로 관찰되기 때문에 췌장 지방의 특정 지표로는 사용될 수 없다[19].
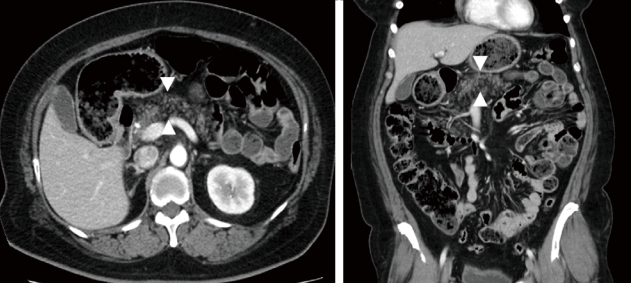
3) 컴퓨터 단층촬영
컴퓨터 단층촬영은 많은 복부 장기의 평가에 사용되고 있고, 하운스필드단위(hounsfield unit, HU)는 췌장 지방축적의 정도를 측정하는 데 사용될 수 있다[2]. 지방췌장은 비장과 비교해서 저음영(low density)으로 관찰되지만(Fig. 3) [2,14], 췌장의 지방축적은 고르게 분포하지 않아서 지방과 실질 세포 (parenchymal cell)의 구분이 어려우며 정확한 췌장 지방 함량을 평가하기 어려울 수 있다[20].
4) 자기공명영상
자기공명영상은 물과 지방의 공명 주파수에서 작은 차이를 확인하고 이를 정량화 할 수 있다. 또한 진단 방법으로써 비침습성, 안전성, 높은 민감도 등의 많은 장점들을 가지고 있고 소아에게도 적용할 수 있다[21]. 그러나 췌장의 작은 크기와 호흡 중 부정확한 위치로 인해 측정의 오류가 발생할 수 있다. 이에 대해서 최근 iterative decomposition of water and fat with echo asymmetry and least-squares estimation (IDEAL)이라는 새로운 기술이 개발되어 췌장의 지방 함량 평가에서 측정 오류를 줄여 주었고[22], 물과 지방의 양성자 세차운동(precession) 차이를 이용하여 지방 분포를 측정하는 magnetic resonance imagingproton density fat fraction (MRI-PDFF)가 개발되어 췌장 내 지방을 보다 객관적으로 정량화하는 데 도움을 줄 수 있다[23]. 하지만 아직까지 이러한 새로운 영상기법에 관한 연구가 부족한 상태로 임상적 사용에 제한이 있기 때문에 추후 이러한 영상기법의 적응증, 민감도, 특이도 및 결정점에 관한 추가 연구가 필요하리라 판단된다.
3. 임상적 결과
1) 대사증후군
최근 발표된 메타분석 연구에서 비알코올 지방췌장질환과 대사증후군, 고혈압, 2형 당뇨병 및 중심 비만의 위험도 증가가 서로 유의한 연관관계가 있음을 보고 하였다[24]. 이처럼 최근 여러 연구들에 따르면 비알코올 지방췌장질환과 대사증후군 사이에 상관관계가 존재함을 보고 하였고[14,25,26], 비알코올 지방췌장질환이 대사증후군의 정의에 포함되어야 한다는 제안도 있었다. 복부 비만에 의해 유발된 지방산의 대사 변화가 심혈관계 질환 및 췌장을 포함한 위장관 질환에 위험요소로 알려져 있다[27,28]. 하지만 비알코올 지방췌장질환과 대사증후군의 연관성이 직접적인 인과 관계인지 또는 비만의 결과인지에 대해서는 아직까지 불확실하며 추후 추가적인 연구가 필요할 것으로 판단된다.
2) 췌장 내분비 기능장애
췌장 베타세포 기능장애 및 인슐린 저항성을 포함하여 비알코올 지방췌장질환에 의해 유발된 내분비 기능장애는 2형 당뇨병의 발병에 직접적인 영향을 준다[11]. 자기공명분광(magnetic resonance spectroscopy)으로 측정된 2형 당뇨병 환자의 췌장지방함량은 2형 당뇨병이 없는 환자에 비해서 훨씬 높았다[29,30]. 또한, 한 단면연구(cross-sectional study) 결과에서 2형 당뇨병의 비율이 대조군에 비해서 비알코올 지방췌장질환 환자에서 유의하게 더 높았다[7]. 이 밖에도 여러 연구에서 비알코올 지방췌장질환과 2형 당뇨병 사이의 연관성을 확인하였다. 비록 비알코올 지방췌장질환과 인슐린 저항성 사이의 연관관계를 확인하기 위한 많은 연구가 진행되고 있지만, 아직까지는 논란의 여지가 있어 이러한 결과를 확정하기위해서는 보다 다양한 인종들을 대상으로 한 장기간의 추적 관찰 연구가 필요하리라 판단된다.
3) 췌장 외분비 기능부전(pancreatic exocrine insufficiency)
췌장 외분비 기능부전은 췌장 효소의 분비가 충분하지 않거나 조기 효소(premature enzyme) 파괴로 인해 십이지장에서 췌장 효소의 활성이 불충분한 것으로 정의된다[31]. 현재까지 비알코올 지방췌장질환과 췌장 외분비 기능부전에 대한 연구 보고는 거의 없는 실정이다. 최근 한 연구결과에 따르면 비알코올 지방췌장질환 환자에서 췌장 외분비 기능평가에 사용되는 지표인 fecal elastase-1의 농도가 대조군에 비해서 유의하게 더 낮음을 보여주었다[32]. 또 다른 연구에서는 비알코올 지방췌장질환이 췌장 외분비 기능부전을 유발할 수 있는 만성 췌장염과 췌관 결석의 주요 원인으로 확인되었다[33]. 일부 생체 외(in vitro) 실험연구들에 따르면 비알코올 지방췌장질환으로 인한 산화 스트레스가 췌장 외분비 기능부전을 유발할 수 있고, 지방세포가 주변분비(paracrine) 효과를 일으켜 췌장 외분비 기능을 감소시킨다고 보고 하였다[34,35]. 하지만 이러한 기전에 대해서는 추후 생체 내(in vivo) 연구가 추가적으로 필요하리라 판단된다.
4) 급성 췌장염
비만이 급성 췌장염의 잘 알려진 위험인자라는 점을 고려할 때 비만과 밀접한 관련이 있는 비알코올 지방췌장질환은 급성 췌장염 환자에서 국소 합병증, 장기 부전 및 사망률의 증가와 유의한 연관성이 있다는 것을 간접적으로 알 수 있다[36-38]. 이러한 기전에 대한 가설로는 비알코올 지방췌장질환이 췌장 미세순환을 감소시켜서 국소 산소함량의 감소와 허혈성 손상을 유발할 수 있다는 것이다[11]. 또한, 지방세포에서 생성된 사이토카인(cytokine)과 지방산에서 발생한 자유 라디칼(free radical)이 함께 전염증성 환경(proinflammatory environment)을 만들어 꽈리세포 손상을 유발하고 급성 췌장염의 중증도를 악화시킬 수 있다[39,40]. 비알코올 지방간질환과 비알코올 지방간염의 연관성과 유사하게 비알코올 지방췌장질환에 의한 췌장염의 상태는 비알코올 지방췌장염(nonalcoholic steatopancreatitis, NASP)으로 명명되고 있다.
5) 수술 후 췌장 누공(pancreatic fistula)
췌장 누공은 췌장십이지장절제(pancreatoduodenectomy) 후 잠재적으로 생명을 위협하는 합병증으로 여러 연구에서 비알코올 지방췌장질환이 수술 후 췌장 누공의 발병 위험을 증가시킨다고 보고 하였다[41-43]. 한 연구결과에 따르면 10%를 초과하는 췌장지방함량이 췌장 누공의 중요한 위험 인자이고, 췌장지방함량은 환자의 예후와 유의한 연관성을 보여주었다[44]. 비알코올 지방췌장질환이 수술 후 췌장 누공의 발병을 촉진시키는 기전에 대해서는 아직 명확히 밝혀지지 않았지만 몇 가지 가설들을 살펴보면 먼저 비알코올 지방췌장질환에서 췌장소장연결(pancreatoenterostomy) 시 허혈 및 손상에 취약할 수 있다는 점과 췌장 지방의 침착이 종종 작은 췌관에 수반될 수 있다는 점 등이 있다[45].
6) 췌장암
비알코올 지방췌장질환은 비알코올 지방간질환과 비슷하게 비알코올 지방췌장염 및 섬유증(fibrosis)에 의해서 췌장암의 진행을 촉진시킬 수 있을 것으로 추정되지만 이에 대한 근거는 아직 부족한 실정이다. 한 조직병리학 연구에서는 비알코올 지방췌장질환과 상피내 신생물(intraepithelial neoplasia) 및 췌장 샘암종(adenocarcinoma)의 발병률 사이에 직접적인 연관성이 있음을 보고 하였다[46]. 그리고 최근 한 후향적 연구에 따르면 내시경 초음파로 진단된 췌장암 환자에서 비알코올 지방췌장질환은 췌장암에 대한 유일한 위험인자로 보고 되었다[47]. 또한 비알코올 지방췌장질환은 췌장암의 전이를 촉진하고, 수술 후 합병증 및 사망률의 위험을 증가시킨다는 보고도 있었다[48,49]. 하지만 비알코올 지방췌장질환과 췌장암 사이의 명확한 인과 관계를 밝히기 위해서는 추후 보다 근본적인 기전 연구와 장기 추적 관찰을 통한 전향적 코호트 연구가 필요할 것으로 판단된다.
7) 비알코올 지방간질환
간과 췌장은 발생학적으로 동일한 배아 내배엽(embryonic endoderm)에서 유래되기 때문에 비만과 관련된 지방축적의 연관성에 대해서도 함께 고려해 볼 수 있겠다. 비알코올 지방췌장질환에 관한 메타분석 연구에 따르면 췌장과 간의 지방률(fat percentage) 사이에 통계적으로 유의한 상관관계가 있음을 보여주었다[16]. 또한 복부 초음파, 자기공명분광 및 조직병리학을 이용한 여러 연구에서 비알코올 지방췌장질환과 비알코올 지방간질환 사이에 의미 있는 양의 상관관계(positive correlation)가 있음을 보여주었다[7,50]. 또 다른 연구에서는 약 70%의 비알코올 지방간질환 환자가 비알코올 지방췌장질환을 동반한다고 보고 하였다[51].
4. 치료
비알코올 지방췌장질환의 초기치료는 비알코올 지방간질환과 비슷하게 식이요법과 체중 감량 및 운동을 통하여 췌장 지방축적을 최소화하는 것을 목표로 해야 한다. 따라서 칼로리 섭취 및 육류 소비를 줄이는 것과 같은 생활습관 개선이 비알코올 지방췌장질환 환자에서 도움이 될 수 있고, 유산소 운동과 저항 운동을 결합한 격렬한 운동 역시 도움이 될 수 있다[52]. 비록 동물모델에서 troglitazone과 같은 당뇨병약이 이점을 보여주기는 했지만[53], 아직까지는 비알코올 지방췌장질환에 대해 승인된 약물 요법은 없는 실정이다. 그리고 비만 수술(bariatric surgery)은 췌장지방함량을 줄이고 베타세포 기능을 향상시킴으로써 인슐린 감수성을 개선시켜 치료에 도움을 줄 수 있겠다[44].
결 론
최근 비만 인구는 지속적으로 증가하는 추세이고, 비만과 연관된 질환들 중에서 비알코올 지방췌장질환은 최근 관심을 받고 있는 새로운 질환 중 하나로써 대사증후군, 췌장 내분비 및 외분비 기능 부전, 췌장염 및 췌장암 등과의 연관성이 보고되고 있다. 하지만 아직까지 비알코올 지방췌장질환에 대한 연구가 부족한 실정이고, 표준화된 진단 및 치료 방법이 제안되지 못하고 있는 상태이다. 하지만 비알코올 지방췌장질환은 가역적인 질환으로써 다양한 영상학적 검사를 통하여 췌장의 지방축적 정도를 정확하게 확인하고, 생활습관 개선 등의 치료에 노력한다면 호전될 수 있으며 이와 연관된 다른 질환들의 발병 위험도를 감소시킬 수 있을 것이다. 따라서 추후 비알코올 지방췌장질환의 발병기전과 각 질환과의 연관성 및 치료 방향에 대한 추가적인 연구가 필요하고 지속적인 관심이 필요할 것으로 판단된다.
Notes
Conflict of Interest
The authors have no conflicts to disclose.