췌장 점액성 낭성 종양과 감별이 어려웠던 췌장내 부비장의 유표피 낭종 1예
요약
췌장내 부비장에서 발생하는 유표피 낭종은 매우 드문 양성 질환으로 대부분 건강 검진에서 우연히 발견되는 경우가 많고, CEA 또는 CA 19-9 등의 혈청 종양 표지자의 상승을 동반하는 췌장의 낭성 종양과 감별이 어려운 질환이다. 저자들은 건강 검진에서 CA19-9의 상승으로 복부 전산화 단층촬영을 시행하고, 췌장 미부의 낭성 종양을 진단받은 환자에서 내시경 초음파 유도 세침흡인검사 및 낭종액 분석을 시행하고 점액성 낭성 종양 의심하에 수술을 시행하였으나, 최종적으로 췌장내 부비장의 유표피 낭종으로 진단된 증례를 경험하여 보고하는 바이다. 췌장내 부비장 유표피낭종은 다른 악성화가 가능한 췌장 낭성 종양과 감별이 어려운 질환이지만, 내시경 초음파 검사, 자기공명 영상 등의 추가 검사를 통해 췌장 미부의 부비장을 수술 전에 진단하면, 추후 불필요한 수술을 줄일 수 있을 것으로 기대된다.
Keywords: 유표피 낭종, 췌장내 부비장, 췌장 낭종
Abstract
An epidermoid cyst arising from intrapancreatic accessory spleen (ECIPAS) is a rare disease. Most patients with an ECIPAS are detected incidentally and could be misdiagnosed as a pancreatic cystic neoplasm such as mucinous cystic neoplasm (MCN) or intraductal p ancreatic mucinous neoplasm (IPMN). We described an ECIPAS with high cystic fluid carcinoembryonic antigen (CEA), which was misdiagnosed as a MCN of pancreas. Fifty one-year-old female was presented with a 2 cm sized non-enhancing pancreas cystic mass on the outside CT scan. Endoscpic ultrasonography (EUS) guided aspiration was performed. It showed a 2.3 × 1.9 cm unilocular cyst nearby 1.6 × 1.1 cm homogenous hypoechoic mass in pancreas tail, and cystic fluid CEA was 1564.18 ng/mL. On the basis of EUS results with elevated fluid CEA level, the presumptive diagnosis is likely to MCN of pancreas, and she underwent a laparoscopic distal pancreatectomy. The final pathology was the epidermal cyst in the intrapancreatic accessory spleen.
Keywords: Epidermoid cyst, Intrapancreatic spleen, Pancreas cyst
서 론
췌장 내 부비장에서 발생하는 유표피 낭종(Epidermoid cyst in the intrapancreatic accessory spleen, ECIPAS)은 1980년 Davidson 등에 의해 처음으로 보고된 이후 국내외에서 현재까지 약 40예가 보고된 드문 양성 질환이다[ 1]. 췌장내 부비장의 유표피 낭종은 대부분 건강 검진에서 우연히 발견되는 경우가 많으나, 때로는 CEA 또는 CA 19-9 등의 혈청 종양 표지자의 상승을 동반하기도 한다[ 2]. 특히 췌장내 낭성 병변으로 발현하기 때문에, 영상 진단 검사 단독만으로는 점액성 낭성 종양(mucinous cystic neoplasm) 또는 췌관내 유두상 점액종양(Intraductal papillary mucinous neoplasm) 등 악성화 가능성 있는 췌장 낭성 종양과 감별이 어렵고, 수술적 절제술 이후 최종 진단이 되는 경우가 많다[ 3]. 저자들은 건강 검진에서 CA19-9의 상승으로 복부 전산화 단층 촬영을 시행하고, 췌장 미부의 낭성 종양을 진단받은 환자에서 내시경 초음파 유도 세침흡인검사 및 낭종액 분석을 시행하고 점액성 낭성 종양 의심하에 수술을 시행하였으나, 최종적으로 췌장내 부비장의 유표피 낭종을 진단한 1예를 보고하는 바이다.
증 례
51세 여자가 건강 검진 목적으로 시행한 혈청 CA19-9의 상승과 복부 전산화 단층촬영 이상 소견을 주소로 내원하였다. 평소 건강하게 지냈다고 하며, 복통 및 체중 감소 등의 소견은 없었다. 혈압은 119/72 mmHg, 체온은 37oC, 맥박은 분당 63회, 호흡은 분당 16회였고, 말초혈액검사에서 백혈구 6,910/mm3, 혈색소 11.6 g/dL, 혈소판은 144,000/mm3이었다. 일반화학검사에서 AST (aspartate aminotrasferase) 21 IU/L, ALT (alanine aminotransferase) 17 IU/L, 알칼리 포스파타제 64 IU/L, 총 빌리루빈 0.9 g/dL, 단백질 6.0 g/dL, 알부민 3.8 g/dL로 정상 소견이었고, 아밀라제 116 U/L (정상 범위 30-118 U/L), 리파제 123 U/L (정상 범위 6-51 U/L), CA 19-9 41.9 U/mL (정상 범위 0-37 U/mL)로 경한 상승 소견이 있었다.
외부병원에서 시행한 복부 전산화 단층촬영에서 췌장 미부에 2 cm 크기의 조영 증강이 되지 않는 낭성 종양이 의심되어( Fig. 1), 추가로 내시경 초음파 검사를 시행하였다. 내시경 초음파 검사에서 췌장 미부에 2.3 × 1.9 cm 크기의 단방성 낭성 병변과 바로 옆에 1.6 × 1.1 cm 크기의 저에코성 병변이 관찰되었다( Fig. 2). 22-gauge needle(Echotip, Cook ®, Bloomington, IN U.S.A)을 이용하여 낭종내 초음파 내시경 유도하 세침흡인검사를 시행하여 4 mL 가량의 황색 맑은 액체를 흡인하였으나, 낭종 주변부위의 저에코성 병변은 주변 혈관으로 가려져 있어 추가의 조직검사를 시행하지 않았다( Fig. 3). 췌장 낭종액 CEA 수치는 1564.18 ng/mL였고, 흡인 세포 검사에는 많은 대식세포 및 혈액 침착이 관찰되었다. 환자는 낭종액 CEA의 과도한 상승을 동반한 췌장내 낭성 종양으로 점액성 낭성 종양 의심하에 복강경 비장 보존 원위췌장절제술(laparoscopic resection of the distal pancreas with preserving spleen)을 시행하였고, 췌장 미부 내에 부비장 조직과 이와 연해 피부 부속기관이 결여되어 있는 다층의 편평상피 내벽으로 이루어진 낭종이 관찰되어 췌장내 부비장의 유표피 낭종으로 최종 진단되었다( Fig. 4).
고 찰
부비장은 전체 인구의 약 10 %에서 발견되며 임상적으로도 비교적 드물지 않은 질환으로, 약 80% 정도는 비장문(perihilar spleen)에서, 17%는 췌장 미부에서 발견된다[ 4, 5]. 췌장내 부비장의 유표피 낭종은 대부분 무증상이며 우연히 발견되기 때문에 최근 건강 검진의 보편화와 복부 영상진단 검사의 발달로 진단이 증가하고 있다[ 2, 6]. 췌장내 부비장의 유표피 낭종은 이번 증례와 같이 CA19-9 증가와 동반되는 경우가 많고, 이는 표피 낭종의 편평 상피세포 조직에서 기인하는 것으로 알려졌다[ 2, 6]. 이러한 유표피 낭종의 점막세포의 기원은 명확치 않으나, 췌관이 췌장내 부비장으로 함입되면서 발생하거나, 편평 상피화생에 동반된 중피성 포함물 또는 태아의 편평 상피에서 유래된 기형종에서 기인하였을 것으로 추정된다[ 7]. 국내에서 췌장 내 부비장의 유표피 낭종은 이번 증례를 포함하여 총 8예가 보고되었다[ 8- 12]. 4명은 남성, 4명은 여성이었으며, 3명에서 복통이 동반되었고, 나머지 5예는 우연히 발견되었다. CA 19-9검사는 4예에서 상승 소견을 보였으며, 모든 증례에서 췌장 미부에 낭종이 위치하였다( Table 1). 췌장내 부비장의 유표피 낭종은 췌장 낭성 병변으로 발현하기 때문에, 임상적으로 점액성 낭성 종양, 췌관내 유두상 점액종양, 신경 내분비 종양의 낭성 변화와 같은 수술적 치료가 필요한 질환과 감별이 어렵고 감별 진단을 위한 방법이 연구되고 있다. 고해상도의 단면 이미지 및 동적인 대조 영상의 발달로 낭종 주변의 부비장에 대한 감별은 상대적으로 용이해지고 있으나[ 6, 13], 췌장 유표피낭종 및 췌장 낭성 종양의 영상진단 소견은 아주 유사하고[ 14] 영상진단검사에서 췌장의 다른 낭성 종양과 췌장 유표피 낭종을 감별하는 것은 여전히 어렵다[ 6]. Itano 등[ 15]은 초음파 및 복부 전산화 단층 촬영에서 낭종 내부의 건락 조직(caseous material)과 장액성 낭종액을 확인하는 것이 유표피낭종 진단에 도움이 되는 영상진단 소견으로 보고하였다. 또한 Iwasaki 등[ 16]은 수술 전 내시경 초음파, 내시경 역행 담췌관 조영술, FDG-PET 검사를 시행하여 정확한 진단이 어려웠던 유피성 낭종을 보고하였으나, 이러한 검사의 진단적 유용성은 아직 검증되지 못하였다. 내시경 초음파 검사 및 세침흡인술은 최근 많이 시도되고 있으나, 췌장내 부비장의 유표피낭종은 매우 드물기 때문에 이에 대한 다수의 연구에서는 제한적인 결과를 제시한다[ 6, 9, 17- 21]. 낭종은 내시경 초음파 검사를 통해서 감별하기 어려우며, 낭종액 세침흡입술 검사는 비특이적인 대식세포들이 존재하고 작은 림프구 흩어져 있는 양상으로 관찰되고[ 18], 낭종액 CEA 수치는 상승된다[ 18]. 췌장내 부비장의 유표피낭종은 벽 내부 또는 주위의 고형 부위(solid portion)를 세침흡입술 조직 검사를 통해 부비장 조직을 확인할 수 있다면 수술 전에 유표피낭종을 진단하는 것이 이론적으로 가능하지만[ 19- 21], 주변 혈관으로 인해 조직검사를 시행하지 못한 이번 증례와 같이 모든 경우에 세침흡인검사를 시행하지는 못한다. 그러나 이번 증례와 같이 내시경 초음파 검사에서 췌장 미부 낭종과 주변 췌실질과는 다른 저에코 고형 조직이 관찰된다면, 췌장내 부비장 유표피 낭종을 의심할 수 있을 것으로 기대된다. 췌장내 부비장 유표피 낭종은 양성 종양이나 보고된 모든 증례에서 수술적 절제술을 시행하였기에 악성화의 유무 등 예후 및 치료에 대해 정확하게 알려져 있지 않다. 결론적으로 췌장내 부비장 유표피낭종은 매우 드문 질환으로 영상진단 검사 또는 임상 소견을 통해 다른 악성화가 가능한 췌장 낭성 종양과 감별이 어렵다. 내시경 초음파 유도 세침흡입법은 수술 전 정확한 진단을 위해 사용될 수 있으며, 내시경 초음파, 전산화 단층촬영 또는 자기공명영상 등의 영상진단 검사는 췌장 미부의 부비장을 진단하여 감별 진단에 기여할 수 있다. 췌장내 부비장의 유표피 낭종의 수술 전 정확한 진단은 추후 불필요한 수술을 줄일 수 있을 것으로 기대된다.
REFERENCES
1. Davidson ED, Campbell WG, Hersh T. Epidermoid splenic cyst occurring in an intrapancreatic accessory spleen. Dig Dis Sci 1980;25:964-967.   2. Higaki K, Jimi A, Watanabe J, Kusaba A, Kojiro M. Epidermoid cyst of the spleen with CA19-9 or carcinoembryonic antigen productions: report of three cases. Am J Surg Pathol 1998;22:704-708.   3. Furukawa H, Kosuge T, Kanai Y, Mukai K. Epidermoid cyst in an intrapancreatic accessory spleen: CT and pathologic findings. AJR Am J Roentgenol 1998;171:271.   4. Halpert B, Alden ZA. Accessory spleens in or at the tail of the pancreas: a survey of 2,700 additional necropsies. Arch Pathol 1964;77:652-654.
5. Halpert B, Gyorkey F. Lesions observed in accessory spleens of 311 patients. Am J Clin Pathol 1959;32:165-168.  6. Hwang HS, Lee SS, Kim SC, Seo DW, Kim J. Intrapancreatic accessory spleen: clinicopathologic analysis of 12 cases. Pancreas 2011;40:956-965.   7. Shudong H, Linxiao Z, Qi S, Kemin C. Epidermoid cyst in intrapancreatic accessory spleen: computed tomography findings and clinical manifestation. Abdom Imaging 2012;37:828-833.   9. Won JK, Lee YJ, Kang GH. Epithelial cysts in the intrapancreatic accessory spleen that clinically Mimic pancreatic cystic tumor. Korean J Pathol 2005;39:437-441.
10. Chung YH, Park HJ, Park IS, et al. An epidermoid cyst in an intrapancreatic accessory spleen. Korean J Med 2009;76:742-745.
12. Kim JH, Chung KH, Oh SY, et al. Two cases of epidermoid cysts in the intrapancreatic accessory spleen mimicking pancreatic cystic neoplasm. Korean J pancreatobiliary 2014;19:52-58.
13. Morohoshi T, Hamamoto T, Kunimura T, et al. Epidermoid cyst derived from an accessory spleen in the pancreas. A case report with literature survey. Acta Pathol Jpn 1991;41:916-921.  14. Park MS, Kim KW, Lim JS, et al. Unusual cystic neoplasms in the pancreas: radiologic-pathologic correlation. J Comput Assist Tomogr 2005;29:610-616.  15. Itano O, Chiba N, Wada T, et al. Laparoscopic resection of an epidermoid cyst originating from an intrapancreatic accessory spleen: report of a case. Surg Today 2010;40:72-75.
16. Iwasaki Y, Tagaya N, Nakagawa A, et al. Surg Laparosc Endosc Percutan Tech. 2011;21:275-279.
17. Kanazawa H, Kamiya J, Nagino M, et al. Epidermoid cyst in an intrapancreatic accessory spleen: a case report. J Hepatobiliary Pancreat Surg 2004;11:61-63.   18. Reiss G, Sickel JZ, See-Tho K, Ramrakhiani S. Intrapancreatic splenic cyst mimicking pancreatic cystic neoplasm diagnosed by EUS-FNA. Gastrointest Endosc 2009;70:557-558.   19. Schreiner AM, Mansoor A, Faigel DO, Morgan TK. Intrapancreatic accessory spleen: mimic of pancreatic endocrine tumor diagnosed by endoscopic ultrasound-guided fine-needle aspiration biopsy. Diagn Cytopathol 2008;36:262-265.   20. Hutchinson CB, Canlas K, Evans JA, Obando JV, Waugh M. Endoscopic ultrasound -guided fine needle aspiration biopsy of the intrapancreatic accessory spleen: a report of 2 cases. Acta Cytol 2010;54:337-340.  21. Lin J, Jing X. Fine-needle aspiration of intrapancreatic accessory spleen,mimic of pancreatic neoplasms. Arch Pathol Lab Med 2010;134:1474-1478.
Fig. 1.
Abdominal computed tomography shows (A: axial view, B: coronal view) 2 cm sized nonenhancing cystic mass in pancreas tail. 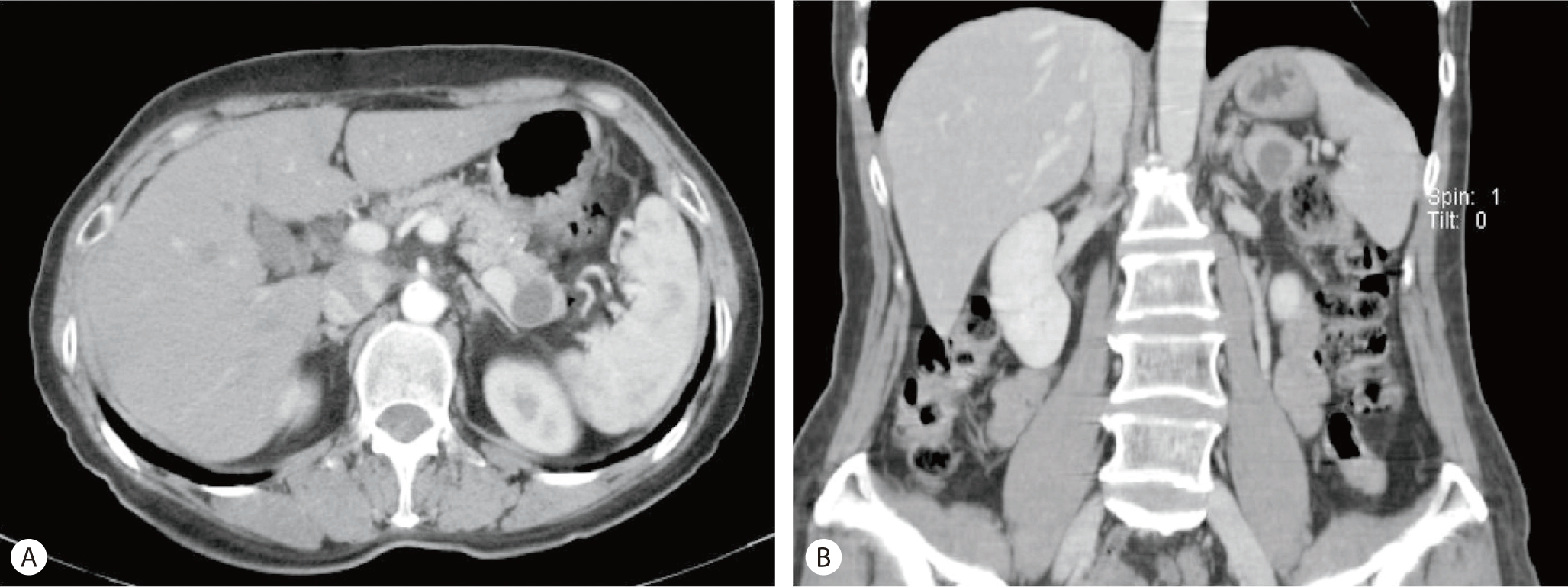
Fig. 2.
Endoscopic ultrasonography shows a 2.3 × 1.9 cm unilocular cystic lesion (arrow) on the pancreatic tail and 1.6 × 1.1 cm homogenous hypoechoic lesion right next to the cystic lesion. The hypoechoic lesion microscopically confirmed accessory spleen. 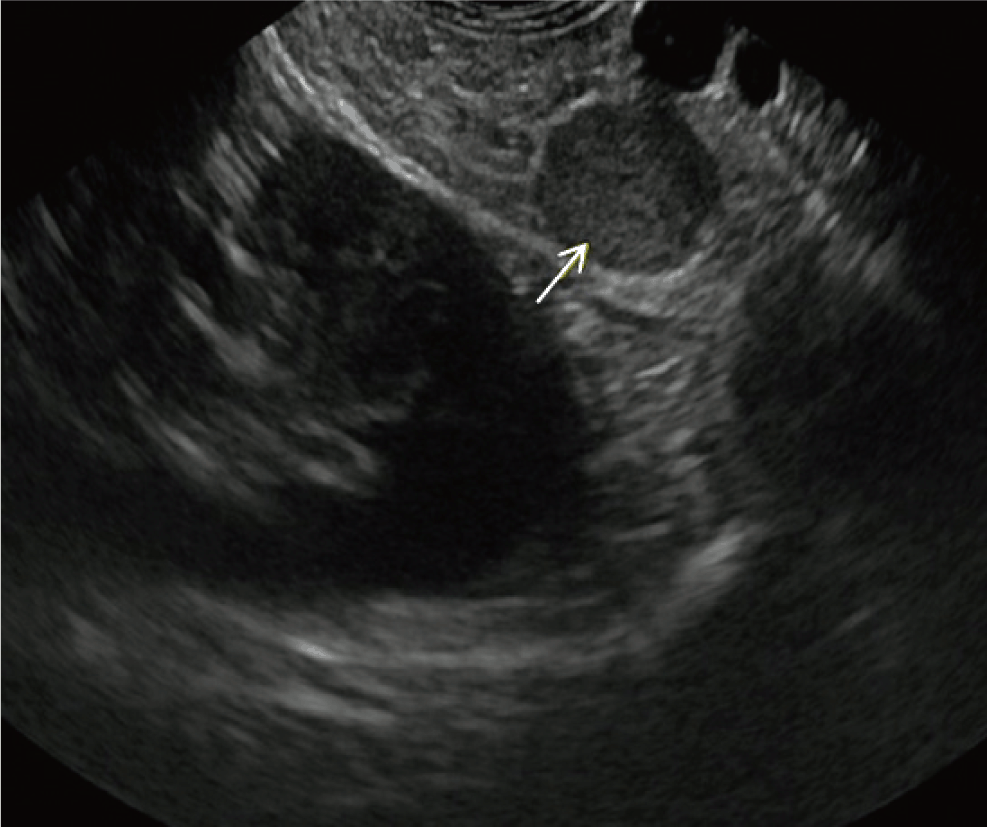
Fig. 3.
Fine needle aspiration was performed in the cystic lesion. 4 cc of yellowish, clear fluid was aspirated. 
Fig. 4.
(A) Microscopically, the cyst was lined by stratified squamous epithelium, but lacked hair or skin appendages (H-E, ×12.5). (B) Microscopically, the unilocular cyst with intervening splenic tissue is separated from the pancreas by a fibrous capsule (H-E, ×12.5). (C) The cystic lesion lined by squamous epithelium (H-E, ×100). 
Table 1.
Summary of the 8 cases of epidermoid cyst in intrapancreatic spleen, including the present case in Korean
|
No |
Author |
Age/Gender |
Site |
Symptom |
Size (cm) |
CT |
MRI |
EUS |
FNA |
Preop diagnosis |
|
1 |
Choi[8] |
54/F |
Tail |
Epigastric pain |
15.0 × 11.0 |
Yes |
Yes |
No |
No |
Mucinous cystic neoplasm |
|
2 |
Won[9] |
32/M |
Tail |
Abdominal pain |
7.5 × 6.5 |
Yes |
No |
No |
No |
Mucinous cystic neoplasm |
|
3 |
Won[9] |
49/F |
Tail |
Asymptomatic |
2.0 × 1.0 × 1.0 |
Yes |
No |
No |
No |
Mucinous cystic neoplasm |
|
4 |
Chung[10] |
37/M |
Tail |
Asymptomatic |
6.0 × 5.0 × 2.5 |
Yes |
No |
Yes |
No |
Mucinous cystic neoplasm |
|
5 |
Hong[11] |
54/M |
Tail |
Abdominal pain |
2.0 × 1.5 |
Yes |
No |
No |
No |
Mucinous cystic neoplasm |
|
6 |
Kim[12] |
47/M |
Tail |
Asymptomatic |
2.3 × 1.8 × 1.7 |
Yes |
Yes |
No |
No |
Mucinous cystic neoplasm |
|
7 |
Kim[12] |
53/M |
Tail |
Abdominal pain |
2.5 × 2.0 × 2.0 |
Yes |
Yes |
No |
No |
Mucinous cystic neoplasm |
|
8 |
Present case |
51/F |
Tail |
Asymptomatic |
2.3 × 1.9 |
Yes |
No |
Yes |
Yes |
Mucinous cystic neoplasm |
|
|
















