서 론
배측 췌장 발육 부전증은 배아기 때 배측 췌장 원기의 발육 부전으로 췌장의 체부와 미부가 형성되지 않은 것으로[1], 현재까지 국외에서 57개의 증례가 보고되었고[2] 국내에서도 드문 기형이다. 대부분의 췌장 발육 부전증의 환자들이 증상 없이 우연히 발견되는 경우이지만, Schnedl, Delhay 등[1,3]이 보고한 연구에 따르면, 환자의 약 30%가 췌장염, 52%의 환자가 당뇨병을 나타내는 것으로 보고되었으며, 매우 드물지만 췌장암이 동반된 9예가 국외에서 1966년도 이후에 보고되었다[4,5]. 국내에서는 9예의 췌장 발육 부전증 증례 보고가 있었으나[6-8], 악성 종양을 동반한 예는 본 증례가 처음으로, 본 저자들은 진행된 췌장암이 동반된 배측 완전 췌장 발육 부전증 1예를 경험하였기에 보고하는 바이다.
증 례
75세 남자 환자가 3개월 전부터 지속된 복부 불편감과 식욕 저하를 주소로 내원하였다. 환자는 3년 전 당뇨를 진단받아 인슐린으로 치료를 받고 있는 것 이외의 특이 병력은 없었으며, 특이 가족력 또한 없었다. 병원 방문 당시 활력징후는 정상이었으며, 복부 진찰에서 복부 팽만감이 있으나 장음은 정상이었고, 압통이나 반발통은 없었다. 일반화학검사에서 총 빌리루빈 0.67 mg/dL, 아스파르테이트아미노전달효소 14 IU/L, 알라닌아미노전달효소 8 IU/L, 아밀라아제 44 U/L, 리파아제 23 U/L이었으며, 혈중 암배아항원(carcinoembryogenic antigen) 2.92 ng/mL, CA19-9 23.39 U/mL으로 모두 정상이었다.
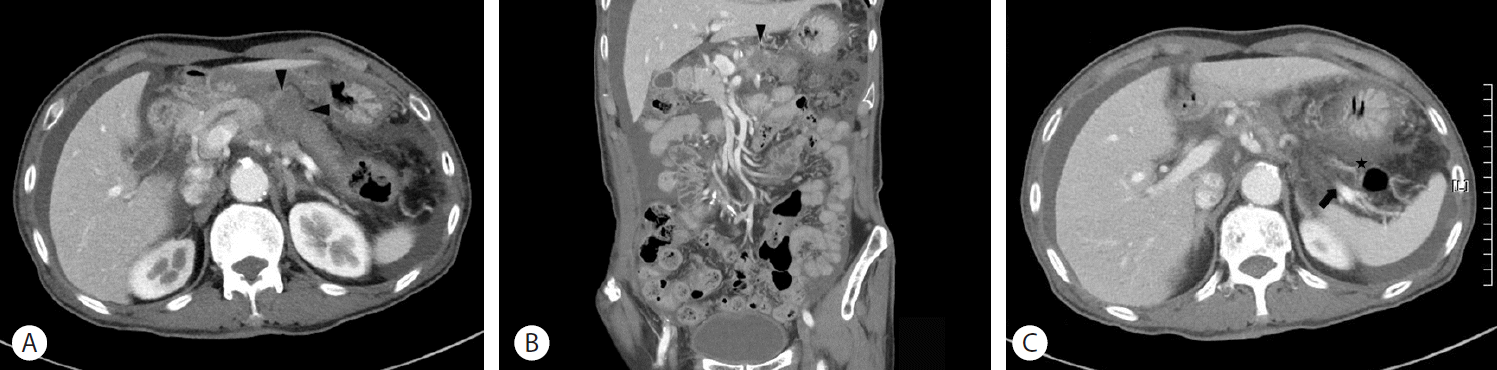
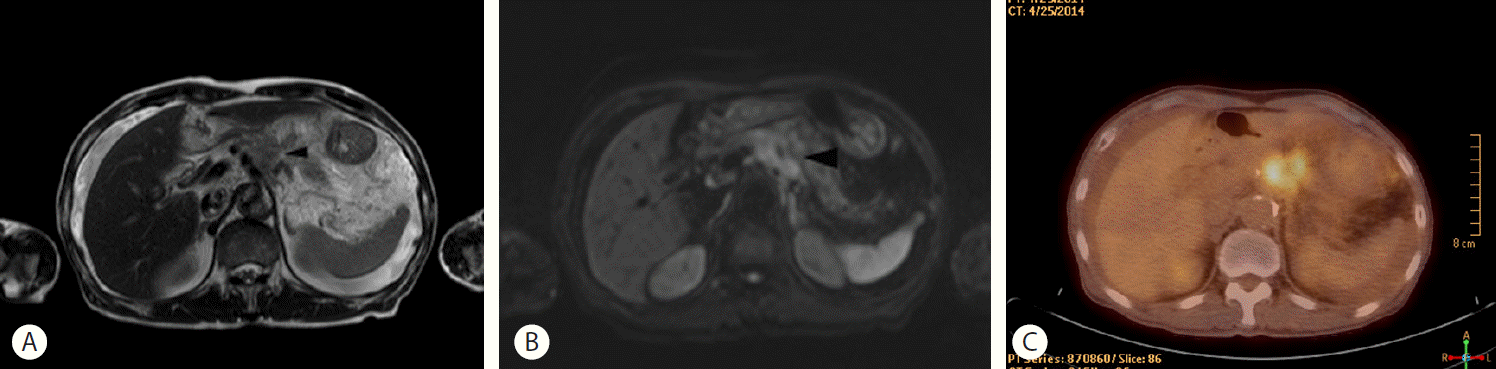
복부 불편감에 대한 감별진단을 위해 시행한 조영증강 복부컴퓨터단층촬영에서는 종괴가 동반된 췌장 두부가 관찰되었으며, 췌장의 체부와 미부 실질은 관찰되지 않았다. 췌장 종괴는 저음영이며 경계가 불분명하였고 복강동맥 주변에 위치하고 있었다(Fig. 1). 그 외에 상당량의 복수와 함께 우상부의 두터워진 복막, 망상-미세결정(reticulo-nodular) 음영을 보이는 장막의 비후 소견이 보였다. 췌장의 체부와 미부가 관찰되지 않아 자기공명췌담관촬영술(magnetic resonance cholangiopancreatography)을 추가로 시행하였으며, 자기공명췌담관촬영술에서도 췌장의 두부와 주 췌관은 정상적이었으나 체부와 미부가 보이지 않았다. T2 강조 영상에서 주 췌관은 정상적이나 부 췌관(santorini duct)과 체부와 미부의 췌관은 관찰되지 않았다(Fig. 2A). 또한 비장 동맥과 비장 정맥으로 둘러싸인 주변과의 경계가 불분명한 고강도 신호를 나타내는 췌장 종괴 소견이 나타났다(Fig. 2B). 췌관의 협착이나 담석에 의한 결손 여부를 명확하게 하기 위하여 내시경역행담췌관조영술(endoscopic retrograde cholangiopancreatography)을 시행하였고, 바터팽대부로부터 5 cm 상부에 주 췌관이 점차 좁아지는 모양을 보이며 췌관의 협착, 음영결손은 보이지 않았으며, 급격한 단절소견 또한 관찰되지 않았다(Fig. 3). 또한 부 췌관은 보이지 않았다. 양전자방출단층촬영(18F-fluorodeoxyglucose positron emission tomography)에서는 췌장 두부(maximal standardized uptake value=5.4)와 장막, 그리고 우측 폐의 2개의 작은 결절에서 조영 상승이 관찰되었다(Fig. 2C). 복수 천자를 시행하여 얻은 세포검사에서 선암종이 확인되었다. 이상의 검사 결과를 통하여 환자는 복강 내 전이, 폐 전이와 같은 타 장기 전이가 진행된 췌장암을 동반한 배측 췌장 발육 부전증으로 진단하였다. 환자와 가족들에게 완화 목적의 항암약물치료를 권유하였으나, 고령과 불량한 전신상태로 인하여 항암약물치료를 거부하였다. 진통제 및 수액요법 등의 보존적 치료 후 증상이 호전되어 퇴원하였으며, 현재 외래에서 추적 관찰 중이다.
고 찰
췌장은 십이지장 내배엽에서 기원하는 배측과 복측 원기(ventral and dorsal bud)로부터 발생한다. 태생 3주경, 복측 원기는 회전하여 태생 6-7주경, 배측 원기와 합쳐진다. 이리하여 췌장의 경부, 체부, 미부 그리고 두부의 상부는 배측 원기로부터 생성되고, 복측 원기는 췌장 두부의 아랫 부분과 갈고리돌기(uncinate process)를 구성한다[9,10]. 췌장의 배아발생(embryogenesis)과 형태발생(morphogenesis)을 하는 동안 발생 과정의 이상으로 여러 가지의 선천성 기형이 발생되며, 예로 분리췌장(pancreas divisum), 고리췌장(annular pancreas), 딴곳췌장(ectopic pancreas), 췌담관 합류이상(anomalous union of pancreatobiliary duct), 췌장 발생 부전(pancreas agenesis) 등이 있다[11].
췌장의 선천적 기형 중에서 배측 원기의 발달이상으로 췌장의 체부, 미부 그리고 부 췌관의 미발생이 나타나는 경우를 배측 췌장 발육 부전증(agenesis of dorsal pancreas)이라고 한다. Schnedl 등[1]의 보고에 의하면 국외에서 1913년부터 2013년까지 배측 췌장 발육 부전증은 총 55예가 있었으며, 통계에 따르면 인구 10,000명당 1명 또는 2명 정도의 발생 비율을 보이는 드문 질환이다. 췌장 발육 부전의 원인은 아직 명확히 밝혀지지 않았으며, 처음부터 배측 원기가 발생하지 않은 경우, 발생 중인 췌장이 허혈성 손상을 입은 경우, 그리고 몇몇 동물실험에서 homeobox gene H1xb9, Raldh-2 (retinaldehyde dehydrogenase 2) 유전자 등이 배측 췌장 발육 부전에 관여한다는 보고가 발표되면서 유전적 결함 등이 하나의 가능성으로 제시되고 있다[11-13].
췌장 발육 부전증은 완전 발육 부전(complete agenesis)과 부분 발육 부전(partial agenesis)으로 구분할 수 있다. 부분 발육 부전은 복측 원기로부터 발생하는 췌장 실질과 주 췌관이 있고, 배측 원기에서 발생하는 경부 및 체부의 일부, 부 췌관, 산토리니관이 관찰된다. 완전 발육 부전은 췌장 실질과 주 췌관은 관찰되나 체부와 미부의 췌관 및 실질, 산토리니관이 결손 되어 있는 것을 말한다[1].
배측 췌장 발육 부전증은 복부컴퓨터단층촬영과 자기공명담췌관촬영술 및 내시경역행담췌관조영술 소견에 의하여 개복술이나 부검 등을 하지 않아도 진단이 가능하다[10]. 1979년에 Sano 등[14]은 내시경역행담췌관조영술과 복부컴퓨터단층촬영을 통해 처음으로 수술 전 배측 췌장 발육 부전증 진단을 하였다. 복부컴퓨터단층촬영은 비침습적 검사로 췌장의 체부와 미부의 존재 및 동반 기형의 유무를 확인할 수 있다. 복부컴퓨터단층촬영에서 췌장 두부가 정상적인 구조를 보이고 체부와 미부가 완전히 보이지 않는다면 배측 췌관 완전 또는 부분 발육 부전증을 의심할 수 있으나, 췌관의 정확한 평가가 어렵다[9]. 내시경역행담췌관조영술에서 배측 완전 췌장 발육 부전증은 췌장 조영시 짧은 주 췌관을 보이고 부췌관과 산토리니관은 관찰되지 않는다. 그러나 췌장 종양에 의하여 췌관이 급격하게 폐색되거나 가늘어지며 협착이 관찰될 수도 있어 감별이 필요하다. 내시경역행담췌관조영술은 보다 침습적인 검사이나 췌관을 정확히 평가할 수 있어 췌장의 선천적 기형인 고리췌장, 분리췌장 등을 감별할 수 있는 장점이 있다. 단점으로는 시술 후 급성췌장염과 같은 합병증이 발생할 수 있다. 자기공명담췌관촬영술은 비침습적이며, 췌관의 양상을 비교적 정확히 알아낼 수 있다[10]. 췌장염이나 악성종양에 의해 췌장 체부와 미부가 위축되어 전산화 단층 촬영에서 배측 췌장 발육 부전으로 잘못 판단하는 경우가 있는데, 이를 가성 발육 부전(pseudo-agenesis)이라고 한다[15]. 이전의 대부분의 증례에서는 수술을 통하여 조직학적 결과가 확인이 되었고, 이로써 다른 질환과 감별을 하였다. 본 증례와 같이 수술이나 부검으로 조직학적 결과를 확인할 수 없을 때에는, 후천적인 원인으로 발생하는 췌장의 지방 대체와 위축과 달리 선천적 발육 부전은 부 췌관의 미발생과 같은 다른 선천적 기형도 동반되는 특징을 이용하여 내시경역행담췌관촬영술과 같은 진단학적 방법을 통해 구분할 수 있다. 즉, 선천적 발육 부전이 아닌 후천적인 원인으로 췌장 체부와 미부의 위축이 발생하는 경우를 감별하기 위해 담췌관조영술을 통해 췌관의 협착유무와 췌관이 끝나는 부위의 양상 및 부 췌관의 유무를 주의 깊게 관찰하는 것이 필요하다. 본 증례에서는 복부컴퓨터단층촬영에서 췌장의 체부와 미부는 관찰되지 않았고 자기공명담췌관조영술과 내시경역행담췌관촬영술에서 체부와 미부의 췌관 및 부 췌관은 관찰되지 않았으며, 췌관의 협착이나 음영 결손, 갑자기 췌관이 단절되는 소견도 보이지 않았다. 또한 자기공명담췌관촬영술에서 지방 축적 소견도 나타나지 않았다. 이로써 췌장의 위축, 지방 대치 등 후천적인 발생 원인을 배제하여 배측 완전 췌장 발육 부전증을 진단할 수 있었다.
췌장 발육 부전증 환자는 복통, 구역감 그리고 저혈당 등의 다양한 증상을 보이기도 하고, 전혀 증상이 없는 경우도 있어 비특이적이다. 국외에서 보고된 증상이나 동반 질환을 살펴보면, 췌장 발육 부전증 환자의 53%에서 복통을 호소하였고, 30%에서 췌장염을 동반하였으며, 드물게 다비장 증후군(polysplenia syndrome)과 췌장암이 동반된 예가 있다[1]. 국내 문헌에 보고된 췌장 발육 부전증은 총 9예로 당뇨병을 동반한 경우는 5예이고, 비장, 신장, 척추 등 다른 선천성 기형을 동반한 경우는 2예가 있었다[6-8]. 하지만 국내에서 췌장암과 같은 악성 종양이 동반된 경우는 본 증례가 처음이다. Rittenhouse 등[4]은 췌장암이 동반된 췌장 발육 부전증 3예를 보고하였는데, 모든 증례가 수술 가능한 병기에서 진단이 되었고, 유문보존췌십이지장절제술(pylorus-preserving pancreaticoduodenectomy)과 보조항암 화학요법을 시행 받았으며, 이와 같은 선천성 질환 환자에게서 췌장암을 위한 선별 검사를 주장하였다. 그러나 본 증례는 국외에서 보고된 예와 달리 타 장기로 전이가 진행된 상태에서 진단되어 수술적 치료는 불가능하였다.
일반인에서 췌장암 발생률은 약 0.6%로 알려져 있다. 췌장 발육 부전에서는 증례가 많지 않아 정확한 통계가 보고되지는 않았으나, 2014년 Zhou 등[2]이 보고한 1예까지 국외에서 췌장 발육 부전으로 57예가 보고되었고, 그 중 췌장암은 9예였다(약 15.7%). 만성 췌장염과 당뇨는 췌장암의 위험 요인 중의 하나로 알려져 있다. 만성 췌장염에서는 반복적인 염증 상태로 염증에 관여하는 사이토카인이 췌장에서 세포의 증식을 자극하여 췌장암 발생이 증가되는 것으로 추정하고 있다. 한 역학 연구에서는 당뇨환자에서 췌장암 발생 위험이 2.89배로 높음이 밝혀졌다. 췌장 발육 부전증에서는 당뇨와 만성 췌장염이 흔하게 동반되어, 드문 질환이지만 정상인보다는 췌장암 발생이 더 높을 것으로 고려된다. 또한 췌장 발육 부전과 췌장암에서 유전자 결함도 연관이 있을 것으로 추정된다. Li, Martin 등[12,13]이 보고한 연구에서 homeobox gene Hlxb9, Raldh2 등의 유전자 발현이 감소되거나 발현되지 않을 때 배측 췌장 발육 부전이 발생하는 것으로 확인하였으며, 췌장 발육 부전 뿐만이 아니라 췌장암과 췌장염에도 같은 신호전달 과정이 연관되었을 것으로 가정하였다. 또한 정상적인 레티노이드산 신호전달을 가지고 있는 동물모델에서는 정상적인 배측 원기 발달을 보였으며, 레티노이드산 농도가 높은 경우에는 생체 외 실험에서 췌장암 세포의 증식이 억제되었다. 이에 레티노이드산 신호전달 과정에서의 결함이 배측 췌장 발육 부전에서 췌장암 발생을 높일 것으로 가정하였으며, 이러한 연구결과를 배경으로 배측 췌장 발육 부전, 췌장암 그리고 췌장염 등 세 질환이 췌장의 발생과 기능에 있어서 공통 경로를 가지고 있을 것으로 추정한다.
국내에서는 췌장 발육 부전증과 동반된 췌장암의 증례가 보고 되지 않았으나 본 증례의 경험으로 진단 및 추적관찰에 있어서 주의가 필요하다고 생각된다. 또한 췌장 발육 부전증의 증례가 많지 않고 발생 기전에 관하여도 알려진 바가 거의 없어, 앞으로 췌장 발육 부전증의 발생 기전 및 악성 종양과의 관계에 대해 더 많은 연구가 필요할 것으로 생각된다.