서 론
경화성 장간막염(sclerosing mesenteritis)의 발생원인은 불명확하며, 주로 50-70대에 발생하는 드문 질환으로 알려져 있다. 다양한 증상으로 복부 불쾌감, 복통, 설사, 체중 감소 등이 동반되며, 신체 검진상 복부에 종괴 형태로 발견되는 경우도 있다. 비특이적인 다양한 증상과 전형적인 방사선학적 소견, 혈액검사 소견이 없어 수술 전에 진단이 되기 어려우며, 장간막 종괴의 형태 또는 연무양 형태로 관찰되는 영상학적 소견과 더불어 이에 합당한 조직학적 확인을 통하여 진단이 이루어질 수 있다[1,2]. 대부분 실제 임상에 있어 복부 컴퓨터단층촬영이 가장 민감도가 높고, 유용하게 사용되나 장간막을 침범하는 다른 여러 질환을 감별하는데 제한점이 있으며 이로 인해 잘못된 진단이 내려지기도 한다[3,4].
본원에서는 3년 전 담낭절제술의 기왕력과 함께 최근의 복통, 설사, 체중 감소 등의 증상이 동반되었고, 복부 컴퓨터단층촬영검사에서도 경화성 장간막염으로 판단되는 소견이었으나, 최종적으로 총담관암의 주변 림프절전이였던 드문 증례를 경험하였다. 이에 경화성 장간막염에 대한 문헌고찰과 함께 증례를 보고하는 바이다.
증 례
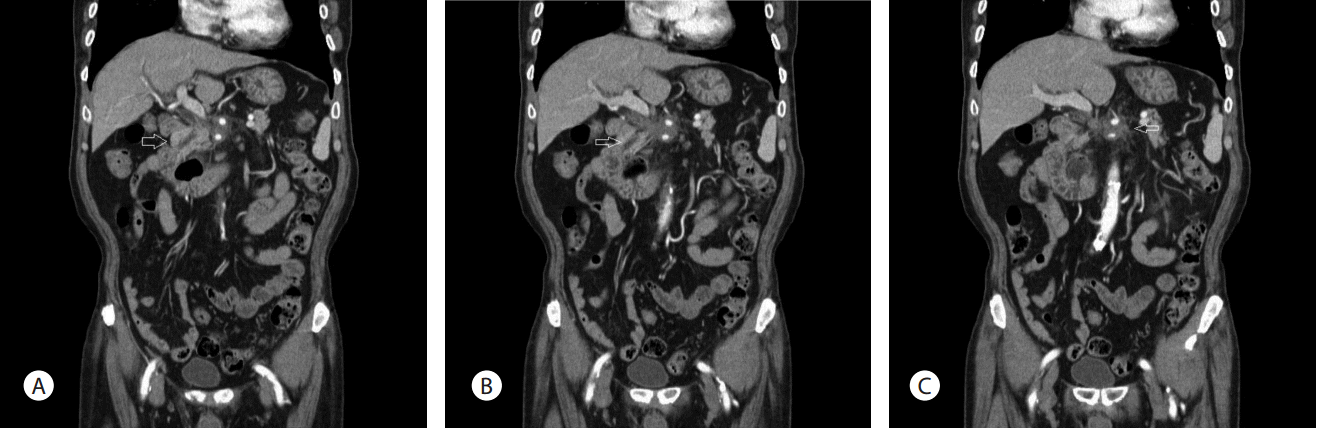
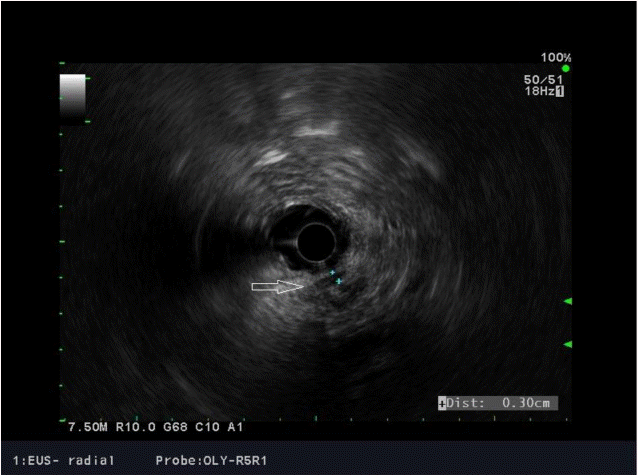
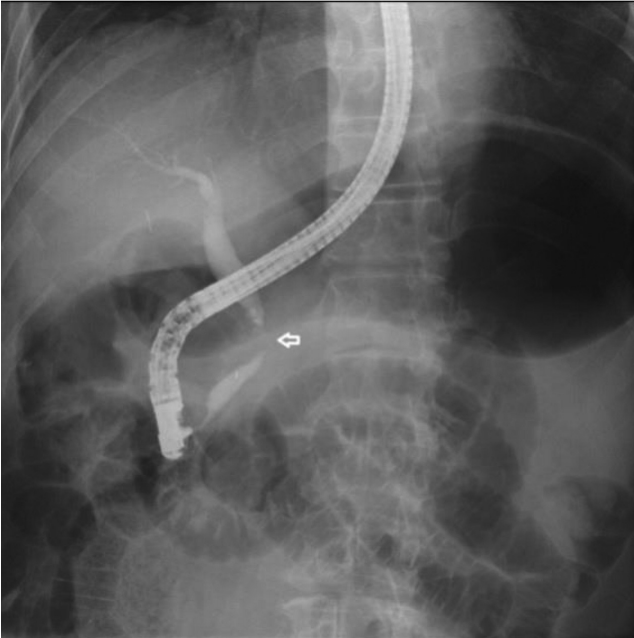
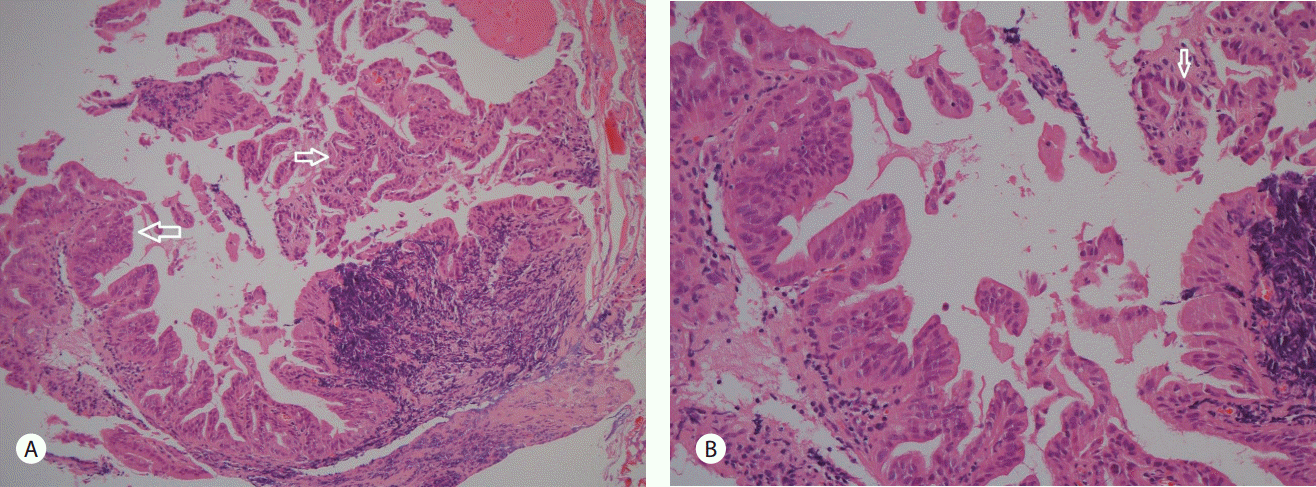
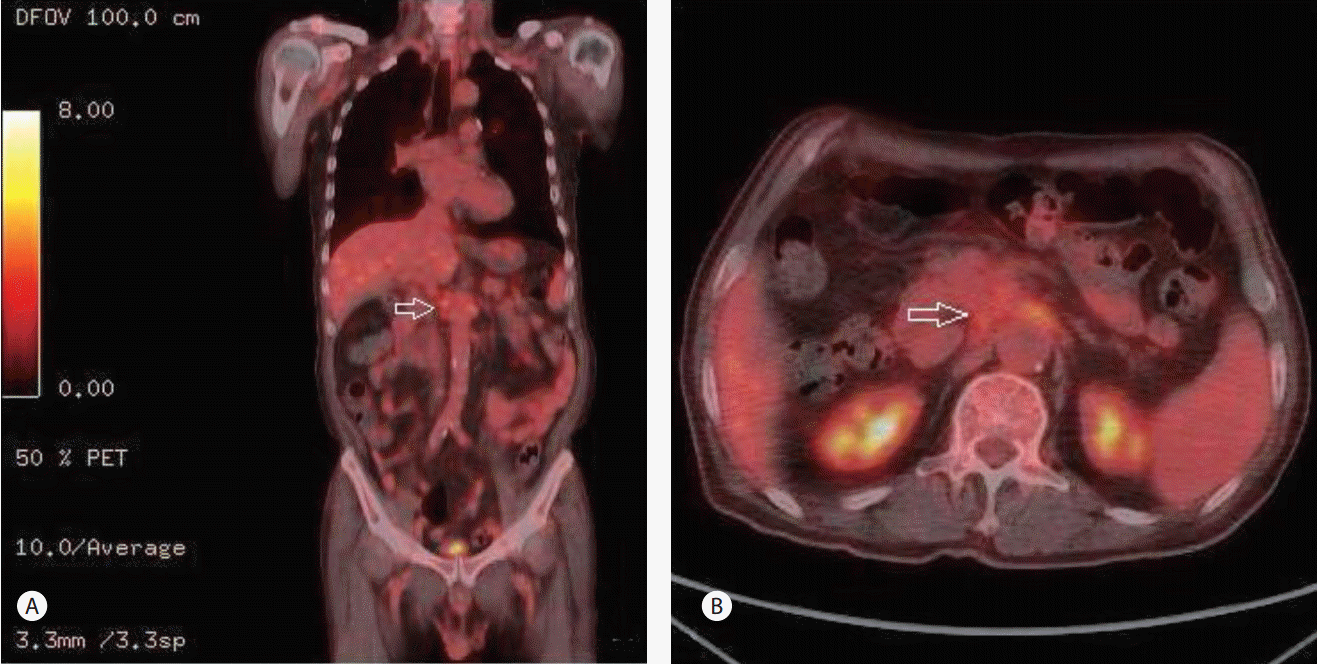
75세 남자가 2012년에 A병원에서 담낭결석으로 담낭절제술을 받았고, 최근 2개월간 지속되는 설사 및 복통을 호소하여, B병원을 방문하여 촬영한 복부 컴퓨터단층촬영상 경화성 장간막염 의증으로 본원에 전원되었다. 2개월간 체중은 10 kg 정도 감소를 보였다. 흡연력은 35갑년이었고, 1주일에 3-4회 소주 3병씩의 음주력이 있었다. 증상은 주로 악화와 호전을 반복하는 설사와 설사시 동반되는 복통이었다. 복부 압통이나 반발통은 관찰되지 않았다. 내원 당시 시행한 혈액검사에서 백혈구 8,130/µL (4,000-10,000/µL), 혈소판 311,000/µL (130,000-450,000/µL), 총 빌리루빈 1.14 mg/dL (0.3-1.2 mg/dL), ALP 204 IU/L (25-100 IU/L), AST 33 IU/L (13-43 IU/L), ALT 60 IU/L (10-40 IU/L), gamma-glutamyl transpeptidase 407 IU/L (5-30 IU/L), LDH 450 IU/L (208-378 IU/L), carbohydrate antigen 19-9 19.21 U/mL (0-37 U/mL), erythrocyte sedimentation rate 35 mm/hr (0-10 mm/hr), C-reactive protein 12.41 mg/L (0-5 mg/L), 아밀라아제 41 U/L (20-104 U/L), 리파아제 44 U/L (22-51 U/L), anti ds DNA 2.88 U/mL (<7.0 U/mL), antinuclear antibody (-), anti-neutrophil cytoplasmic antibody (-), rheumatoid factor 6.5 IU/mL (0-18 IU/mL), anticyclic citullinated peptide antibody 7.0 U/mL (0-7 U/mL), IgG 1,091 mg/dL (800-1,700 mg/dL), IgA 263 mg/dL (100-490 mg/dL), IgM 56 mg/dL (50-320 mg/dL), IgG4 14.96 mg/dL (2.4-121 mg/dL), carcino-embryonic antigen 3.75 ng/mL (0-5 ng/mL)로 측정되었다. 위내시경 검사상 장상피화생을 동반한 결절성 위염 소견을 보였다. 대장내시경검사에서 말단 회장부에 미란을 동반한 다발성의 점상발적들이 보여, 조직검사를 시행하였으며, 병리 결과에서 만성 회장염으로 판독되었다. 아울러 추가로 현미경적 대장염을 감별하기 위해 에스상결장 및 직장부에서 불특정 조직검사를 시행하였고, 병리 결과에서 만성 대장염으로 확인되었다. B병원에서 촬영한 복부 컴퓨터단층촬영상 담관의 협착이 관찰되나 담관내 특이 병소를 보이지 않으며, 담관 협착 및 근위부 총담관 확장 소견은 담낭절제술과 관련된 것으로 추정하였다. 복강동맥 및 상장간막동맥 주위 연무양 감쇄상은 경화성 장간막염으로 사료되었다(Fig. 1). 간헐적 설사 증상이 지속되었으나 복통이 심하지는 않았고, 급성 병색이나 탈수 및 전반적 증상이 심하지 않아 대증 치료 후에 퇴원하였다. 이후 외래에서 장간막염의 진행 정도를 추적관찰하여 스테로이드 및 호르몬 치료를 계획하였다. 추적관찰 목적으로 한달 후 복부 컴퓨터단층촬영을 촬영하였고, 이전 복부 컴퓨터단층촬영상에 비하여 장간막의 침윤은 큰 변화를 보이지 않았으나 총담관의 협착은 경미하게 진행한 양상이었다(Fig. 2). 담관의 협착에 대하여 보다 정밀한 검사가 필요하다고 판단하였고, 이에 내시경초음파검사를 시행하였으며, 종괴나 담석의 증거는 관찰되지 않았고, 경도의 협착 및 담관벽의 비후가 의심되었다(Fig. 3). 한편, 내시경적 역행성 담관조영술에서 팽대부로 유도철선을 삽관하였으나, 총담관 중간의 협착부위에 굴곡이 심하여, 협착부 상방으로 유도철선의 진행에는 실패하였다(Fig. 4). 총담관 중간의 협착부에서 조직검사를 시행하였고, 병리 결과에서 분화도가 양호한 선암종으로 확인되었다(Fig. 5). 이후 경과관찰 과정에서 환자의 총 빌리루빈이 6.12 mg/dL로 증가되었고, 우상복부의 불편감을 호소하여, 경피경간담즙배액술(percutaneous transhepatic biliary drainage)을 시행하였다. 추가로 시행한 양성자방출 컴퓨터단층촬영술(positron emission tomography computed tomography)에서 복강동맥 및 상장간막동맥 주변으로 고대사성 연부 조직 음영(hypermetabolic soft tissue density, SUVmax 4.5) 소견이 보였으며, 경화성 장간막염보다는 암종의 전파(cancerous encasement)에 합당한 소견이었다(Fig. 6). 이후 환자에게 고식적 항암화학 요법, 항암방사선 치료 등을 권유하였으나, 적극적인 치료는 원치 않아서 대증적 치료를 하면서 외래 경과관찰 중이다.
고 찰
경화성 장간막염은 장간막을 침범하는 특발성 염증 및 섬유화 과정 중에 있는 질환으로, 병태 생리학적으로 이들 과정은 위장관의 관강이나 주변 장간막 혈관을 침범할 수 있다. 경화성 장간막염에 대해서 현재까지 밝혀진 명확한 병태기전은 없으며, 지방세포의 괴사(mesenteric lipodystrophy)에서 만성 염증상태(mesenteric panniculitis)로 진행된 뒤 마지막으로 섬유화 과정(retractile mesenteritis)으로 진행하는 일련의 과정 중 일부분으로 추정된다[5]. 원인 역시 명확히 밝혀지지는 않았으나 관련한 임상질환들로 복부수술 및 외상의 과거력, 자가면역질환, 부종양증후군(paraneoplastic syndrome), 허혈성 손상, 감염성 질환 등이 보고되었다[1,5]. 또한 60세 이상에서 호발하며, 남녀의 차이는 보고마다 다르나, 대체적으로 남자에서 더 흔한 것으로 나타났다[2]. 노령에서 호발하는 이유는 어린 연령에서는 복강내 지방이 상대적으로 적기 때문으로 추정된다. 경화성 장간막염의 증상으로 복통, 구역, 구토, 설사, 체중 감소, 발열 등이 보고되었다[1,2]. 경화성 장간막염의 진단은 이에 부합하는 영상학적 이미지와 더불어 조직학적 결과를 토대로 결론내려질 수 있다. 경화성 장간막염의 컴퓨터단층촬영에서의 특징은 장간막의 연부조직 종괴로 가장 흔히 나타나며, 다소 특징적 소견으로 장간막 혈관 주변의 특징적 지방후광(fat ring sign)과 종괴 주변을 둘러싸고 있는 고감쇄의 띠가 특징인 종양의 가성피막(tumor pseudocapsule) 등이 있다. 아울러 장간막에 별개의 종괴 없이 장간막 지방 및 림프절의 뿌연 감쇠상(misty attenuation) 등을 보이며 이로 인해 간유리음영(misty mesentery) 상이 관찰될 수 있다[3,6,7]. 경화성 장간막염은 공장의 장간막의 기시부와 나란히 주행하며, 5 mm 이하의 작은 림프절과 함께 구멍이 뚫린 또는 거친 석회화를 보일 수 있다. 이런 복부 영상학적 소견이 경화성 장간막염의 진단에 많은 도움을 주나, 다른 허혈성, 악성, 감염 및 염증성 질환에서도 비특이적으로 관찰될 수가 있기 때문에 다른 질환을 배제하기 위한 적극적 검사를 시행하는 것이 중요하며, 확진을 위해서는 조직검사가 필요하다[3,4]. 이를 위해 미세침흡인생검이 시행될 수 있으나, 경화성 장간막염의 병리학적 특이성이 다소 부족하므로, 정확한 진단을 위해 보통 복강경 및 개복술을 통한 조직학적 검사가 필요하다[8]. 경피적 현미경적 검사에서 대부분 섬유화 조직 및 만성 염증 소견을 보이며, 다른 림프종 및 gastrointestinal stromal tumor (GIST), 장간막 섬유화증과의 감별을 위하여 면역화학적 염색이 이루어지기도 한다[5,9]. 일부 증례에서 magnetic resonance imaging (MRI)가 경화성 장간막염의 진단에 도움을 줄 수 있다고 보고되었다. 컴퓨터단층촬영과 유사 소견을 보이나 병변의 병리학적 다양성에 따라(잔여 지방, 염증, 섬유화의 정도 및 석회화의 유무) T2 강조영상에서 신호의 강도가 다양하게 나타날 수 있다. 특징적 주변부 섬유화 피막(peripheral fibrous capsular) 소견은 mesenteric panniculitis와 retractile mesenteritis의 구분 및 경화성 장간막염과 장간막을 침범하는 악성 질환들을 감별하는데 가치가 있다고 보고하고 있다[10]. 그 외 양성자방출 컴퓨터단층촬영술을 이용하여, 경화성 장간막염과 림프종과 같은 악성 질환과의 감별에 도움을 받을 수 있다. 심한 염증상태에서의 경화성 장간막염의 경우 양성자방출 컴퓨터단층촬영술에서 위양성으로 나오는 경우도 드물게 보고되나 대부분 음성으로 보고되고 있다[11,12]. 그리고 장간막의 연무양 감쇄상을 보이는 복부 컴퓨터단층촬영상 병변에 양성자방출 컴퓨터단층촬영술을 시행한 증례 보고에 있어서 optimal diam-max (maximum short-axis diameter of mesenteric nodules) >10 mm 또는 SUVmax >3.0일 때 림프종과 같은 악성 병변의 가능성이 높은 것으로 보고되었다[13]. 현재까지 총담관암의 림프절 전이와 경화성 장간막염을 감별하기 위한 SUV max cut off value에 대해 명확히 보고된 자료는 없으나, 원발성 경화성 담관염과 같은 담관의 양성 병변과 담관암과의 감별을 위해 SUV max 및 tumor to normal liver activity ratio가 도움이 될 수 있다는 보고가 있으며, 명확히 확립된 기준은 없으나 일부 논문에서는 SUVmax >3.5-3.6인 경우 악성 병변의 감별에 있어 의미 있는 기준이 될 수 있다고 하였다[14,15].
결국 경화성 장간막염의 경우 임상 증상이 비특이적이고, 특징적 혈역학적 검사소견이 없어, 컴퓨터단층촬영상의 영상학적 이미지와 더불어 추가적으로 조직학적 검사까지 병행하여 진단을 내릴 수 있으며 MRI 및 양성자방출 컴퓨터단층촬영술이 도움을 줄 수 있다. 경화성 장간막염에 있어 정확하게 정해진 치료법은 없으나 스테로이드, 콜히친(colchicine), 면역억제제, 경구 프로게스테론을 통한 약물 치료가 이루어지고 있으며, 장폐쇄와 같은 합병증 및 필요에 따라 수술이 병행되기도 한다[2]. 하지만 경화성 장간막염의 치료 방법 및 예후와는 임상상이 상이한 림프종, 복막암, 유암종, 장간막 섬유화증, 장간막 부종 등과 같은 장간막을 침윤하는 다른 질환에 대한 감별이 우선적으로 이루어져야 한다.
본 증례에서도 환자의 담낭절제술의 과거력, 증상 및 영상학적 검사상 경화성 장간막염에 합당한 소견으로 보였으나, 경과관찰 중 복부 컴퓨터단층촬영술상에서 담관 협착의 경미한 진행 의심 소견으로 역행성 담관 조영술을 통한 조직검사 및 양성자방출 컴퓨터단층촬영술을 시행하였으며 최종적으로 총담관암으로 인한 주변 림프절전이로 확진되었다. 이처럼 장간막을 침윤하는 악성 질환이 경화성 장간막염으로 오진되는 경우가 있을 수 있으므로, 환자의 진단에 있어 면밀한 주의가 필요할 것으로 사료된다.