요약담관 낭종은 담관에 발생하는 선천성 담관 확장증을 의미하며, 담도계에 발생하는 비교적 드문 질환이다. 담관 낭종과 관련된 합병증으로는 담석 형성, 담관염, 췌장염이 있으며, 무엇보다도 담관암이 발생할 수 있어서 낭종 절제술 같은 외과적 절제가 치료 원칙이다. 담관 낭종을 수술한 후에도 담관 낭종의 불완전 절제로 인해 남아있는 낭종에서 담도계 암이 발생하는 경우가 종종 있다. 저자들은 담관 낭종으로 수술받은 후 일부 남아있는 췌장내 총담관 부위 낭종에서 수술 15년 후 담관암이 발생한 1예를 경험하여 보고하고자 한다. 이 증례는 담관 낭종의 치료로써 완전 절제의 중요성과 정기적인 추적 검사의 필요성을 일깨워준다고 볼 수 있다.
AbstractAmong complications of choledochal cysts, malignant transformation is most concerning and management of choledochal cyst now includes complete cyst excision, whenever possible. In cases of choledochal cyst associated with pancreaticobiliary maljunction like our case, cholecystectomy along with the resection of dilatated bile duct and the biliary diversion are generally performed. However, incomplete cyst excision can result in malignant transformation within the remnant cyst. We present the case of cholangiocarcinoma arising from remnant intrapancreatic cyst 15 years after choledochal cyst excision in a patient with Todani type 1 choledochal cyst associated with pancreaticobiliary maljunction. We learn from the case that a careful long-term follow-up is needed in patients with choledochal cysts if residual cyst is remained after excision.
서 론담관 낭종은 담관에 발생하는 선천성 담관확장증을 의미하며, 담도계에 발생하는 비교적 드문 질환이다. 남성보다 여성에서 흔히 발생하며, 서양보다는 동양에서 많이 보고되고 있다. Todani에 의해 5가지의 낭종 형태(제1형, 총담관확장형; 제2형, 간외담도의 낭성 게실; 제3형, 총담관 말단부 담관확장형; 제4A형, 간내외 담관확장형; 제4B형, 간외담관의 다발성확장형; 제5형, 간내담관의 다발성 낭종형)로 분류가 확립되었고, 제1형과 제4A형이 제일 흔하다[1].
담관 낭종의 임상증상은 복통, 황달, 복부 종괴가 주로 나타나지만, 최근 영상검사의 증가로 인해 임상증상 없이 발견되는 경우도 증가하고 있다[1]. 담관 낭종과 관련된 합병증으로는 담석 형성, 담관염, 췌장염이 있으며, 무엇보다도 담관암이 발생할 수 있어서 낭종 절제술 같은 외과적 절제가 치료 원칙이다[2].
담관 낭종을 수술한 후에도 담관 낭종의 불완전 절제로 인해 남아있는 낭종에서 담도계 암이 발생하는 경우가 종종 있다[3]. 저자들은 담관 낭종으로 수술받은 후 일부 남아있는 췌장 내 총담관 부위 담관 낭종에서 낭종 절제수술을 시행받은 지 15년 후에 담관암이 발생한 1예를 경험하여 문헌고찰과 함께 보고하는 바이다.
증 례54세 남자가 3개월 전 시행한 복부 컴퓨터단층촬영에서 담관 낭종 수술 후 남아있는 췌장내 총담관 부위 낭종 안에 고형병변이 새롭게 발견되어 추가적 검사를 위해 입원하였다. 환자는 15년 전에 Todani 제1형 담관 낭종과 이에 동반된 췌담관합류이상을 진단받고(Fig. 1), 낭종 절제술과 담관공장문합술(Roux-en-Y choledochojejunostomy) 및 담낭 절제술을 시행받았다. 이후 덜 절제되어 남아있는 췌장내 총담관 부위 낭종을 본원에서 복부 컴퓨터단층촬영으로 1년마다 추적관찰을 하고 있었다. 환자는 호소하는 증상은 전혀 없었고, 내원 당시 활력징후는 혈압 118/88 mmHg, 심박수 75회/분, 호흡수 16회/분, 체온 36.5도로 안정적이었다. 흉부 검사에서는 이상이 없었고, 복부 검사에서도 촉진상 압통은 없었다. 검사실 소견은 일반 혈액 검사에서 백혈구 5,200/mm3, 혈색소 15.5 g/dL, 혈소판 285,000/mm3였으며, 아스파르트산 아미노전이효소 21 IU/L, 알라닌 아미노전이효소 21 IU/L, 알칼리성 인산분해효소 95 IU/L, 총 빌리루빈 0.6 mg/dL로 모두 정상소견이었고, 종양표지자인 carcinoembryonic antigen (CEA) 0.30 ng/mL, CA 19-9 6.7 U/mL도 정상범위 내였다.
복부 컴퓨터단층촬영과 자기공명 담도췌관조영술에서는 남아있는 췌장내 총담관 부위 낭종 내부에 담석과 함께 3개월 전 단층촬영에서 관찰된 고형병변이 여전히 관찰되었으며, 5 mm에서 7 mm로 크기 증가가 있었다(Fig. 2).
환자는 증상은 없었지만, 지난 10여 년간 매년 시행한 추적검사에서 보이지 않던 고형 병변이 새로 확인되었다는 점과 그 크기가 증가되었다는 점에서 암성 변화로 생각하고 수술을 시행하기로 계획하였다. 추가적으로 시행한 양전자단층촬영에서는 남은 췌장내 총담관 부위 낭종 내부에서 최대 standardized uptake value 2.8의 경증의 과대사가 확인되었으나 림프절 비대나 원격 전이는 확인되지 않았다.
환자는 유문 보존 췌십이지장절제술을 시행받았고, 육안으로 보이는 검체에서는 췌장두부의 덜 절제되어 남아있는 담관 낭종 표면에서 융기성 병변이 확인되었고(Fig. 3), 최종 병리조직 검사에서 선편평세포암종으로 확진되었다(Fig. 4). American joint committee on cancer 7판의 병리학적 병기는 IIB (T3N1M0)였고, 림프절 12개 중 1개에 전이가 확인되었고, 절제면에서 암세포는 발견되지 않았다. 림프혈관강 침윤이 있어 외래에서 항암화학 방사선 치료 concurrent chemoradiation therapy를 시행하기로 하고, 안정적인 상태로 퇴원하였다.
고 찰담관 낭종은 담도암의 전구병변이며, 나이가 증가함에 따라 담도계 암의 발생률이 증가하므로, 담관 낭종은 증상의 유무와 진단 당시의 나이에 관계없이 진단되는 대로 수술이 가능하다면 완전 절제하는 것이 치료 원칙이다[1].
담관 낭종 환자에서 췌담관합류이상은 약 70%에서 확인되며[3], 또한 췌담관합류이상은 담관 낭종의 발생기전 중 하나로 생각된다. 본 증례와 같이 췌담관합류이상이 동반된 담관 낭종 환자에서의 담도계 암 발생기전은 췌액의 담도계로의 역류에 의한 만성 염증을 기반으로 해서 과형성-이형성-암 과정(hyperplasia-dysplasia-carcinoma sequence)을 밟는 것으로 이해되고 있다. 이는 통상의 담도암이 선종-선암 경과를 밟거나 새로이(de novo) 발암하는 것과는 차이가 있다[4].
일반적으로 담관 낭종 환자에서 췌담관합류이상이 동반된 경우가 동반되지 않은 경우보다 담도계 암의 발생률이 유의하게 높다[5]. 일본의 전국조사 통계에 따르면, 담관 낭종과 췌담관합류이상이 같이 동반된 경우는 담도계 암 발생 환자의 약 2/3이 담낭에, 약 1/3이 담도에 암이 발생하였다. 반면에 담관낭종이 동반되지 않은 췌담관합류이상에서는 담도계 암 발생 환자의 약 90%가 담낭에서 암이 발생하였다[6]. 따라서 임상에서는 췌담관합류이상 및 담관 낭종이 동시에 있는 환자에서 담도계 암의 발생을 막기 위해 예방적으로 담낭 절제술과 간외 담관 낭종 절제술을 시행하고, 담도상피세포가 췌액에 노출되는 것을 가능한 줄여주기 위해 수술적 우회술(예를 들면, 간관공장문합술)을 추가로 시행한다[6]. 반면에 담관 낭종을 동반하지 않은 췌담관합류이상 환자에서는 담관 절제술 없이 담낭 절제술만을 예방적으로 시행하는 것이 일반적이다[4].
문헌에 따르면 담관 낭종 수술 후 일부 남아있는 췌장내 담관 낭종으로 다시 수술을 받은 41명의 환자들을 추적해 본 결과 6명의 환자(15%)에서 담관암이 발생하였고, 이들은 모두 남은 췌장내 담관 낭종에서 암이 발생하였다. 따라서 담관 낭종 절제시 췌장내 담관 낭종 부분도 완전 절제하는 것이 중요하다[7]. 담관 낭종이 췌장내 담관 부위까지 확장된 경우에는 완전 절제를 위해 정상적인 주췌관과 합류하는 부위 바로 직상방까지 췌장내 총담관 낭종을 절제하는 것이 원칙이다. 담관낭종이 방추 모양으로 확대되어 있어 주췌관이 잘 보이지 않아 주췌관을 손상시킬 위험이 크기 때문에 췌담관합류이상의 유무를 정확히 알고, 절제 전에 담관조영술, 담관내시경, 금속 클립을 사용해 절제 부위를 정해놓는 것이 안전하다. 악성화되지 않은 Todani 제1형 담관 낭종 환자에서 췌십이지장절제술을 담관 낭종 절제술에 더해서 추가로 시행하는 경우는 췌장 두부 쪽에 췌석과 복잡한 췌관 기형을 동반한 재발성 만성 췌장염 환자에서 고려할 수 있다[8].
낭종 절제술을 시행받은 환자들은 종양 발생의 위험이 감소하지만 일반인에 비해서는 여전히 높은 것으로 알려져 있다. 담관 낭종 절제 후에도 종양 발생이 약 0.7-6% 환자에서 보고되었으며, 이는 수술 후에도 남아있는 낭종조직이나 동반된 췌담관합류이상이 원인으로 생각된다[9-11]. 담관 낭종은 원칙적으로 침범된 모든 담관을 위치에 상관없이 완전 절제해야 하지만 본 증례와 같이 췌장내 총담관 부위나 간내 담관을 침범한 경우는 완전 절제가 기술적으로 어려울 수 있다. 특히 간 양엽의 간내 담도를 침범하는 Todani 제4A형의 담관 낭종의 경우 한쪽 간엽이나 분절을 침범한 경우는 부분 간 절제술을 추가로 시행하기도 하지만, 양엽 모두를 침범한 경우에는 담관낭종의 완전 절제가 불가능하여 간외 담관을 포함해서 간문부담관까지 최대한 절제한 후 간관공장문합술을 시행하는 것이 일반적이다. 간문부담관보다 가는 간내 담관을 무리하게 공장과 연결시키는 경우, 술 후 담관 협착이 합병증으로 발생할 수 있다[12].
본 증례와 같이 담관 낭종 수술 후 남은 췌장내 총담관 부위낭종에서 담관암이 발생한 17명의 환자에 대해 일본에서 발표한 논문이 있다. 이 중 9명은 Todani 제1형, 5명은 Todani 제4A형, 3명은 확인되지 않았으며, 수술 후 평균 13.6년(4-26) 후에 담관암 발생이 확인되었다. 진단과정이 확인된 15명의 환자 중 13명은 복부 증상이 있어 시행한 추가 검사에서 담관암이 확인되었으며, 종양표지자(CEA, CA19-9)를 측정한 8명 중 7명에서 적어도 둘 중 하나의 종양표지자가 상승하였다. 진단 후 13명은 적극적인 치료(췌십이지장절제술 6명, 유문 보존 췌십이지장절제술 4명, 췌장전적술 3명)를 시행하였고, 3명은 근본적 절제가 불가능하여 완화 수술을 시행하였다. 나머지 1명은 간으로의 전이가 확인되어 항암 치료만 시행하였다. 적극적인 치료에도 불구하고 1년 누적 생존율은 약 40%에 불과하였고, 평균 생존 기간은 12개월이었다. 이는 발견 당시 이미 담관암이 진행된 상태로 발견되어 적극적인 치료에도 불구하고 예후가 좋지 않았던 것으로 추정된다[13]. 그러나 본 증례는 증상이 없고, 매년 추적한 영상 검사에서 우연히 담관암이 확인된 환자로 상대적으로 예후가 좋을 것으로 예상된다(Table 1).
담관 낭종 수술 시에 간내 담관 낭종 및 췌장내 담관 낭종 같은 부위에 위치하여 완전 절제가 불가능하였다면 더 초기에 담관암을 발견하기 위해 영상 및 종양표지자를 주기적으로 추적 관찰하는 것이 중요하다고 생각한다. 또한 장기간에 걸쳐서 복부단층촬영(computed tomography)으로 추적 검사를 시행하는 것은 방사선 노출 위험이 있으므로 자기공명 담도췌관조영술(magnetic resonance cholangiopancreatography)이 단층촬영 검사를 대체할 수 있겠다. 본 증례는 담관 낭종을 수술받고 매년 정기적인 추적 검사 중 15년 만에 발견된 잔류 낭종내 담관암 증례로, 담관 낭종의 치료로써 완전 절제의 중요성과 정기적인 추적 검사의 필요성을 일깨워준다고 볼 수 있다.
REFERENCES1. Lee SE, Jang JY, Lee YJ, et al. Choledochal cyst and associated malignant tumors in adults: a multicenter survey in South Korea. Arch Surg 2011;146:1178-1184.
2. She WH, Chung HY, Lan LC, Wong KK, Saing H, Tam PK. Management of choledochal cyst: 30 years of experience and results in a single center. J Pediatr Surg 2009;44:2307-2311.
3. Liu YB, Wang JW, Devkota KR, et al. Congenital choledochal cysts in adults: twenty-five-year experience. Chin Med J (Engl) 2007;120:1404-1407.
4. Kamisawa T, Ando H, Suyama M, et al. Japanese clinical practice guidelines for pancreaticobiliary maljunction. J Gastroenterol 2012;47:731-759.
5. Ragot E, Mabrut JY, Ouaïssi M, et al. Pancreaticobiliary maljunctions in European patients with bile duct cysts: results of the multicenter study of the French Surgical Association (AFC). World J Surg 2017;41:538-545.
6. Morine Y, Shimada M, Takamatsu H, et al. Clinical features of pancreaticobiliary maljunction: update analysis of 2nd Japan-nationwide survey. J Hepatobiliary Pancreat Sci 2013;20:472-480.
7. Xia HT, Yang T, Liang B, Zeng JP, Dong JH. Treatment and outcomes of adults with remnant intrapancreatic choledochal cysts. Surgery 2016;159:418-425.
8. Mabrut JY, Bozio G, Hubert C, Gigot JF. Management of congenital bile duct cysts. Dig Surg 2010;27:12-18.
9. Kobayashi S, Asano T, Yamasaki M, Kenmochi T, Nakagohri T, Ochiai T. Risk of bile duct carcinogenesis after excision of extrahepatic bile ducts in pancreaticobiliary maljunction. Surgery 1999;126:939-944.
10. Watanabe Y, Toki A, Todani T. Bile duct cancer developed after cyst excision for choledochal cyst. J Hepatobiliary Pancreat Surg 1999;6:207-212.
11. Ono S, Fumino S, Shimadera S, Iwai N. Long-term outcomes after hepaticojejunostomy for choledochal cyst: a 10- to 27-year follow-up. J Pediatr Surg 2010;45:376-378.
12. Kim JW, Moon SH, Park DH, et al. Course of choledochal cysts according to the type of treatment. Scand J Gastroenterol 2010;45:739-745.
13. Mizuguchi Y, Nakamura Y, Uchida E. Subsequent biliary cancer originating from remnant intrapancreatic bile ducts after cyst excision: a literature review. Surg Today 2017;47:660-667.
Fig. 1.MRCP findings. (A) MRCP shows Todani type 1 choledochal cyst (a gallbladder collapses). (B) The arrow indicates the junction site of main pancreatic duc t & common bile duc t. The common bile duct seems to join main pancreatic duct at a right angle, sugesting the presence of pancreaticobiliary maljunction. MRCP, magnetic A B resonance cholangiopancreatography. 
Fig. 2.Radiological findings of contrast-enhanced CT scan. (A) Before surgery, CT shows cystic dilatation of common bile duct without a mass or stone. (B) Remnant intrapancreatic cyst is noted after 2 months of surgery. (C) Solid portion (arrow) is seen within the remnant intrapancreatic cyst after 15 years of surgery. CT, computed tomography. 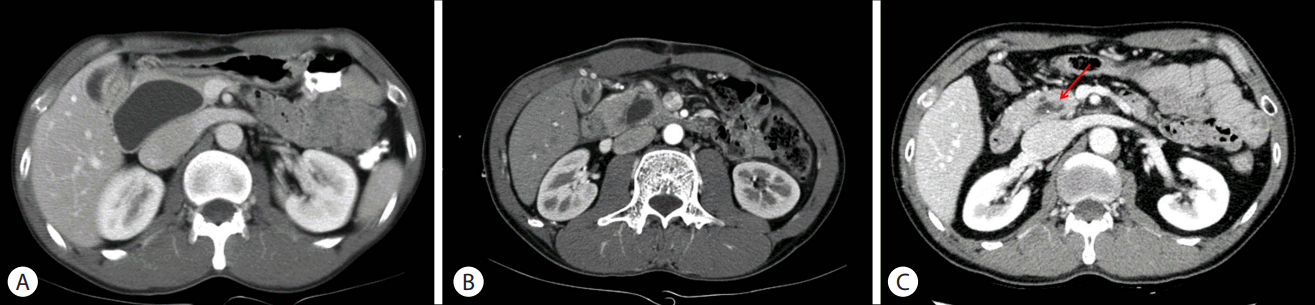
Fig. 3.Bivalve image of the surgical specimen shows choledochal cyst. The cystic wall demonstrates irregular nodularity (arrowheads) and choledocholithiasis (arrow). 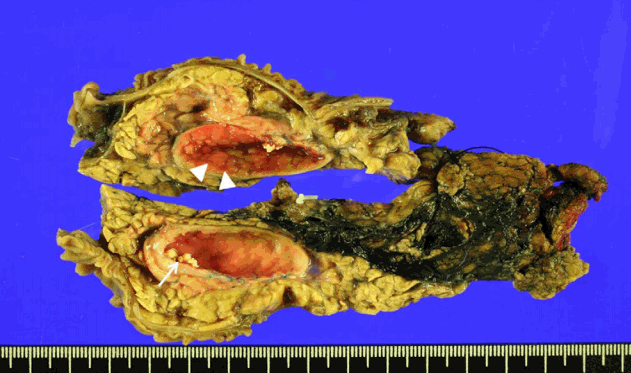
Fig. 4.(A) Representative images of well-differentiated cholangiocarcinoma component. Cancer cells make variable sized well-formed glandular architecture, which infiltrate into bile duct wall (H&E, ×40). (B) Squamous cell carcinoma component is located in advanced tumor edge. Sheets of tumor cells with abundant eosinophilic cytoplasm with pleomorphic nuclei (H&E, ×200). 
Table 1.Reported cholangiocarcinoma cases developed within intrapancreatic remnant cyst after surgical excision of the choledochal cyst
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||