서 론
2018년 국립암센터 중증 암 등록본부에서 발표한 자료에 의하면, 2016년 우리나라에서 췌장암으로 진단받은 사람은 총 6,685명으로, 전체 암종 발생 분율에서 2.9%로 9번째를 차지하였다[1]. 최근 진단 기술의 발전 및 새로운 항암 치료제의 개발에도 불구하고 국내 췌장암의 5년 생존율은 11.7%로 위암과 대장암 등 다른 암종에 비하여 여전히 불량한 예후를 나타내었다. 미국 National Cancer Institute의 자료에 따르면 2018년 미국에서 췌장암으로 진단받은 사람은 총 55,440명이고 전체 암종 발생 분율에서 3.2%를 차지하였으며, 2009년부터 2015년까지 췌장암의 5년 생존율은 9.3%에 불과하였다[2]. 이는 췌장암의 조기 진단이 어렵기 때문인데, 췌장이 후복막강에 위치하고 있어 종양이 발생하여도 초기에는 증상이 없는 경우가 많고, 증상이 발생한다고 하더라도 복부 통증, 소화불량 등 소화기 질환에서 흔히 볼 수 있는 비특이적인 증상을 보이는 경우가 대부분이기 때문이다. 위암, 대장암 등은 내시경을 통한 조기 발견이 암으로 인한 사망률을 감소시킨다는 사실이 잘 알려져 있지만[3,4], 아직까지 췌장암에 대한 효과적인 선별 검사 방법이 없는 것도 조기 진단을 어렵게 하는 원인 중 하나이다. 또한 췌장암 종양 세포가 초기부터 빠르게 성장하고 타 장기에 전이가 쉽게 발생하는 악성의 경과를 보인다는 생물학적 특징을 가지고 있기 때문에[5], 진단 당시에 이미 진행된 병기에서 발견되는 경우가 많다. 하지만 췌장암을 조기에 진단하는 경우 비교적 양호한 예후를 기대할 수 있기 때문에[6], 췌장암의 조기 진단을 위하여 영상학적, 분자 생물학적 표지자의 개발에 많은 연구가 이루어지고 있다[7].
아직까지 조기 췌장암에 대한 정의는 통일되어 있지 않으며 크기, 절제 가능 여부, 완치 가능성에 기초하여 달라질 수 있다. 넓은 의미의 조기 췌장암은 통상 종양의 크기를 2 cm 미만으로 정의하며, 이것은 절제 가능성에 근거한 개념이다. 좁은 의미의 조기 췌장암은 종양의 크기가 1 cm 미만이며 췌장 피막 내에 국한되어 있고, 림프절 전이가 없는 것인데 이는 암의 완치가능성에 근거한 정의이다[8]. 미국 National Cancer Institute의 통계 자료[2]에 따르면, 췌장암이 췌장 실질 내에 국한된 경우 (American Joint Committee on Cancer Stage I에 해당) 최근 5년 생존율은 34.3%로 보고되었다. 일본의 췌장암 통계에서는 췌장 종양의 직경이 1 cm보다 작을 경우에는 5년 생존율이 80%에 달한다고 보고하고 있다[9]. 따라서 췌장암의 조기 발견은 생존율을 증가시키는 데 있어서 핵심적인 요소라고 할 수 있다.
내시경 초음파(endoscopic ultrasound, EUS)는 췌장암의 조기 진단에 유용한 영상학적 진단 방법으로 주목을 받고 있다. EUS는 장관 내 공기, 복벽 지방, 뼈 등에 의해 복부 초음파에서 잘 관찰되지 않는 부위에서도 고해상도의 영상을 얻을 수 있어 췌장 병변의 진단에 많이 활용되고 있다. 특히 EUS 유도하 세침흡인술(EUS-guided fine needle aspiration, EUS-FNA)이 개발된 이후에는 조직학적 확진을 위해서도 많이 사용되고 있다[10]. 본고에서는 조기 췌장암에 있어서 EUS의 역할에 대하여 알아보고자 한다.
본 론
1. EUS의 역할 및 장점
1) 병변의 조기 발견
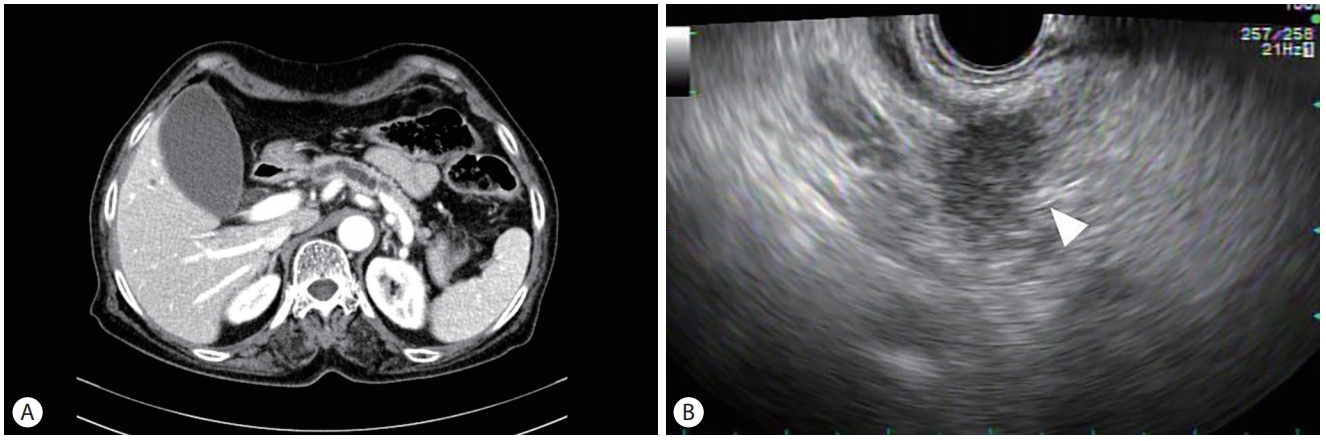
현재 EUS는 췌장의 종양을 발견하는 데 있어서 높은 민감도로 주목을 받고 있다. 췌장 종양을 진단하는 영상학적 기법을 비교한 22개의 연구를 종합하여 보았을 때, 췌장 종양의 진단에 있어서 computed tomography (CT)의 민감도는 74%였지만 EUS의 민감도는 98%에 달하였다.11 EUS는 고해상도 영상을 얻기 때문에, 종양의 크기가 작을 경우 그 유용성이 크다. 3 cm 미만의 췌장 종양을 대상으로 영상학적 기법을 비교한 연구에 의하면 CT의 민감도는 53%였지만 EUS의 민감도는 93%에 달하였으며, 67%의 민감도를 보인 magnetic resonance imaging (MRI)보다 더 우월하였다[12]. 2 cm 이하의 작은 췌장 종양을 대상으로 한 연구에서도 EUS는 CT에 비하여 우월한 민감도를 보였다(94% vs. 50%) [13]. 실제로 임상에서는 다른 영상 검사에서는 관찰되지 않지만, EUS에서는 관찰 가능한 췌장 종양을 드물지 않게 경험할 수 있다(Fig. 1).
췌장암이 의심될 때 흔히 임상에서 가장 먼저 시행하는 검사는 CT이다. 하지만 CT에서 췌관 확장이 확인되거나 황달, 종양 표지자 상승 등 임상적으로 췌장암이 의심되지만 CT에서 이를 설명할 수 있는 췌장 종양이 뚜렷하게 보이지 않는 경우에는 EUS를 반드시 고려해봐야 하겠다. 특히 EUS는 췌장암 진단에 음성 예측도가 높아, 초음파에서 종양이 없다고 판단된 경우에는 거의 확실하게 췌장암의 가능성을 제외할 수 있다는 연구 결과도 있었다[14]. 이러한 연구 결과를 바탕으로 일본췌장학회에서는 췌장암이 의심되는 환자에게 시행하는 영상학적 진단 기법으로 CT, MRI와 더불어 EUS를 권유하고 있다[15]. 그리고 2011년 미국에서 개최되었던 췌장암 고위험군에 대한 선별 검사(cancer of the pancreas screening, CAPS) 회의에서도 대부분의 전문가들이 췌장암의 선별 검사 도구로써 EUS를 권유하였다[16].
하지만 모든 상황에서 EUS가 췌장 종양 진단에 우수한 민감도를 보이는 것은 아니다. 최근에 급성 췌장염의 병력이 있거나, 만성 췌장염이 동반되어 있거나, 미만성(diffuse) 췌장암의 경우에는 종양의 발견이 어려워 주의가 필요하다[17].
2) 절제 가능성의 판정
National Comprehensive Cancer Network (NCCN) 가이드라인에 의하면 췌장암의 절제 가능 여부는 복강 동맥(celiac trunk), 상간장막 동맥(superior mesenteric artery), 상간장막 정맥(superior mesenteric vein), 문맥(portal vein) 등의 침범 정도에 따라 resectable, borderline resectable, unresectable로 판단한다[18]. 따라서 췌장 종양과 그 주변 혈관들의 침범 여부가 환자의 치료 계획 결정에 아주 중요하다. EUS는 췌장암의 병기 설정에 아주 유용한 진단 방법 중 하나이다. 종양 자체뿐만 아니라 림프절, 혈관 등 주위 인접 장기들까지 평가가 가능하기 때문이다. 혈관 침범을 진단하는 데 있어서 EUS의 민감도와 특이도를 조사한 많은 연구가 있었는데, 최근 시행한 메타 분석 결과에 의하면 혈관 침범에 대한 민감도는 66-72%, 특이도는 89-94%로 확인되었다[19,20]. 침범 여부의 정확도는 혈관에 따라 차이가 난다. 간문맥 침범에 대한 민감도는 80% 이상으로 CT와 혈관 조영술보다 우월한 것으로 알려져 있다[21]. 하지만 상간장막 동맥, 정맥(superior mesenteric artery, superior mesenteric vein), 복강 동맥(celiac trunk)의 침범을 평가하는 데 있어서는 CT가 EUS보다 민감도가 우월하다[22]. 이는 이들 혈관이 큰 종양에 의하여 가려지거나, EUS로써는 전체 경로를 파악하기 어렵기 때문이다. 그리고 종양의 크기에 의해서도 영향을 받는다. 앞서 언급하였듯이 작은 종양은 EUS의 정확도가 우수하지만, 3 cm 이상의 큰 종양에서는 초음파 투과도의 한계로 인하여 종양보다 심부에 위치해 있는 혈관과의 관계를 파악하기가 어렵다. 따라서 병기를 결정하는 데 있어서 3 cm 이상이거나 원격 전이는 CT가, 작은 종양은 EUS가 우수하므로 상호보완적이라고 할 수 있다[23]. 암의 절제 가능성에 대한 민감도는 69% (23-95%), 특이도 92% (63-100%), 정확도는 77%로 보고되고 있으며 CT와 유사하다[22,24,25].
3) 조직학적 확진
앞서 언급하였듯이 EUS는 고해상도 이미지로 인하여 작은 췌장 종양을 발견하는 데 유리하다. 하지만 CT, MRI와 같은 다른 영상학적 검사와 달리 EUS가 가지는 가장 차별화되는 장점은 영상을 보면서 실시간으로 조직을 채취할 수 있다는 데 있다. EUS 세침 흡인 검사(EUS-FNA)는 1991년 췌장암의 진단에 처음 시행되었으며[26], 그 이후 복강 내 혹은 종격동 내 위치한 병변 조직을 채취하는 데 있어서 덜 침습적이고 안전한 검사로 많이 시행되고 있다. 최근 시행되었던 메타 연구에 의하면 췌장암을 진단하는 데 있어서 EUS-FNA의 민감도는 85-92%, 특이도는 96-98%로 보고되었다[27-30]. 임상에서 많이 사용되는 가이드라인을 중심으로 췌장암에서 EUS-FNA가 필요한 경우를 간략히 살펴보면 다음과 같다. American Society for Gastrointestinal Endoscopy 가이드라인[31]에서는 수술적 치료가 적합하지 않은 질환에서 수술이 아닌 다른 방법으로 조직 검사가 필요한 경우 EUS-FNA가 유용하다고 언급하고 있다. 예를 들어 자가 면역성 췌장염이나, 림프종같이 내과적 치료를 요하는 질병이지만 악성 종양으로 오인될 가능성이 있는 경우 EUS-FNA가 감별 진단에 도움이 될 수 있다. 또한 American Society for Gastrointestinal Endoscopy 가이드라인에서는 EUS-FNA로 확진이 되지 않았지만 조직학적 진단이 필요한 경우에 EUS 세침 생검(EUS-guided fine needle biopsy, EUS-FNB)을 고려해야 한다고 명시하고 있다. 과거에는 췌장 머리(head) 혹은 구상 돌기(uncinated process) 병변에 대하여 EUS-FNB의 진단 정확도는 EUS-FNA에 비하여 낮았는데[32], 이는 주사침이 경직되어 있고, 췌장 머리/구상돌기에서 EUS-FNB 시에 내시경 선단이 예각(acute angulation)을 이루어 기술적으로 어려웠기 때문이다[31]. 하지만 nitinol 합금으로 된 유연성이 향상된 주사침이 개발되면서 췌장 두부/구상돌기에 있는 병변에서도 높은 진단율을 보인 연구가 보고되어[33], 이러한 단점은 극복될 것으로 예상한다. NCCN 가이드라인[18]에 의하면 경계 절제성(borderline resectable) 췌장암에서 신보조요법(neoadjuvant therapy) 전에 조직 검사의 방법으로 EUS-FNA를 권고하고 있다. 이는 CT-guided FNA에 비하여 EUS-FNA가 진단율 및 안정성에서 우월하며, 복막 전이의 위험이 낮기 때문이다[34]. 반면 European Society of Gastrointestinal Endoscopy 가이드라인[35]에서는 어떤 특정 상황에서 조직학적 진단이 필요한지 명시하고 있지 않다. 만약 췌장 종양이 절제가 가능하다고 판단될 경우에 모든 환자에서 EUS-FNA가 필요한지에 대해서는 아직 논란이 있다. 앞서 언급한 NCCN 가이드라인에는 수술적 절제가 가능한 상황이면 EUS-FNA는 반드시 필요하지 않다고 언급하고 있다. EUS-FNA는 음성예측도가 상대적으로 낮아[36] 조직 검사 결과에서 음성이 나온다고 해서 암이 아니라고 확정을 할 수가 없으며, 바늘의 경로를 따라서 종양이 파종되는 보고들[37]이 있기 때문에 반대하는 의견이 있다. 하지만 EUS-FNA는 복부 초음파나 CT 유도하 경피적 조직 검사에 비하여 주사침의 경로가 짧기 때문에 암세포의 파종 가능성이 낮으며[34], 췌장 머리 쪽에서 조직 검사를 할 경우에는 십이지장을 통하여 조직 검사를 하게 되므로 설령 파종이 된다고 하더라도 수술로 인한 절제 구역에 포함되기 때문에 임상적으로 큰 문제가 되지 않는다. 하지만 EUS-FNA도 제한점이 있다. 우선 기술적으로 어렵고 EUS-FNA를 능숙하게 잘 다룰 수 있는 고도로 훈련된 내시경 전문의가 필요하다는 점이다. 또한 앞서 언급하였듯이 조직 검사 결과는 음성이지만 실제로는 악성 종양이 존재하는 낮은 음성 기대치(negative predictive value)이다. 이는 췌장암 주위에 섬유화 반응이 많이 동반되기 때문이라고 생각된다[38]. 따라서 췌장염이 있는 경우는 염증이 가라앉기를 기다렸다가 반복 시행하거나, 영상학적, 생화학적 진단에서 췌장암이 거의 확실하고 수술이 가능하다고 판단되면 EUS-FNA를 반복하는 것보다는 바로 수술을 시행하는 것이 좋은 판단일 수 있다[39,40].
4) 조영 증강 EUS (contrast enhanced EUS, CE-EUS)
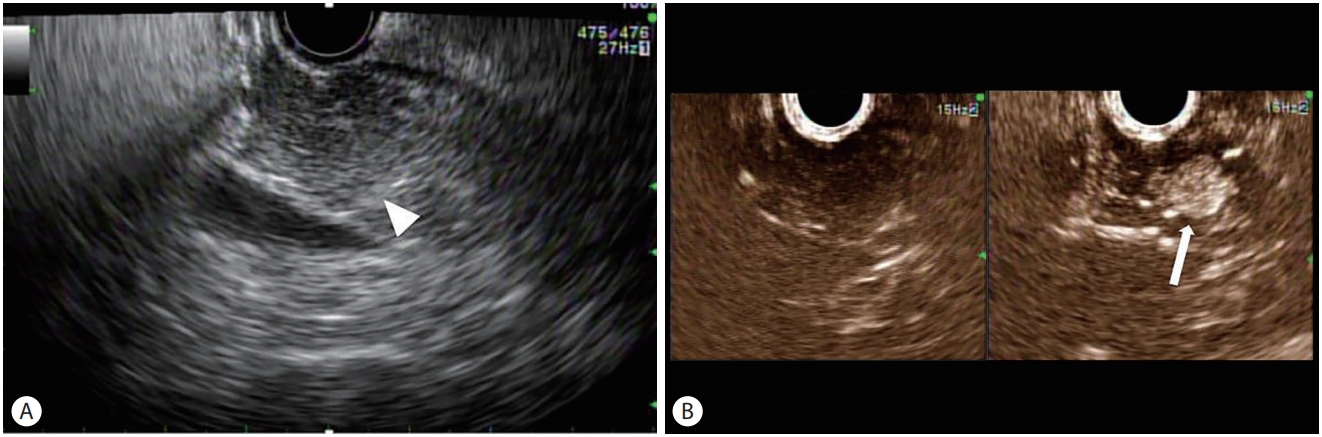
앞서 언급하였듯이 EUS는 작은 췌장 종양을 발견하는 데 아주 예민한 검사이다. 하지만 췌장암이나 신경내분비 종양, 그리고 종괴 형성 만성 췌장염(mass-forming chronic pancreatitis)은 EUS로 관찰하였을 때 대부분 저에코성(hypoechoic) 음영으로 관찰되기 때문에 EUS 소견만으로 이런 종양들을 감별하는 것이 쉽지 않을 수 있다[41]. 이런 경우 조영 증강 EUS (CE-EUS)를 사용하면 종양의 특성을 파악하고 감별하는 데 도움이 된다. CE-EUS에 사용되는 조영제는 단백질, 지방 등 생체에 적합한 물질로 둘러싸여 있는 미세 거품 공기인데, 조영제 주입 후 조영제에 특화된 영상 기법인 하모닉 영상을 얻음으로써 췌장의 관혈류와 역동적인 미세 순환의 패턴까지 관찰할 수 있게 한다[42]. 조영 증강 동안 관류가 잘 되지 않는 경우를 hypoenhancing lesion이라고 하는데, 이것은 악성 종양을 시사하는 소견이다. 반면 인슐린종 같은 신경내분비종양(neuroendocrine tumor, NET)은 미세혈관이 풍부하게 발달되어 있기 때문에 hyperenhancing lesion으로 보인다(Fig. 2). 췌장 종양을 감별하는 데 있어서 CE-EUS는 뛰어난 정확도를 보이는데, 최근 시행된 메타 연구에 의하면 민감도는 93-94%, 특이도는 88-89%로 확인되었다[43,44].
5) 탄성 초음파(elastography)
췌장 조직을 평가하는 데 있어서 탄성 초음파(elastography)의 사용이 2006년에 처음 보고되었다[45]. 탄성 초음파 내시경은 조직의 압박에 따라 부드러운 조직은 변형이 큰 반면에 딱딱한 조직은 변형도가 적은 조직의 경직도(stiffness)에 따라 달라지는 strain을 평가하는 것이다. Strain은 경직도가 낮아질수록 dark blue, cyan, green, yellow, red 컬러로 실시간으로 나타난다[46]. 탄성 초음파가 처음 개발되었을 시에는 실시간으로 확인되는 조직의 색깔에 따라 진단을 하는 정성적(qualitative)인 방법만이 가능하였다[47]. 하지만 이러한 방법은 매우 주관적이었기 때문에 strain ratio를 이용한 정량적인(quantitative) 진단 방법이 개발되었다. A영역을 종양 부위(target tissue)로 지정하고, B영역을 종양 밖의 주위 조직에 상응하는 영역(reference tissue)으로 지정한 다음, 두 영역의 strain 값의 비(B/A)를 구하고 이를 strain ratio라고 부른다[48]. 86명의 환자를 대상으로 췌장 병변에 대한 strain ratio를 비교한 연구[49]에 의하면 정상 췌장의 평균 strain ratio는 1.68, 염증성 종양은 3.28, 췌장암은 18.12로 췌장암의 strain ratio가 통계적으로 유의하게 높은 결과를 나타내었다. 하지만 구체적으로 어떤 cut-off value로 악성 조직과 양성 조직을 나눌 것인가에 대한 합의는 아직 이루어지지 않았다. 그 이유 중 하나는 췌장 탄성 초음파에 있어서 어느 부위를 reference tissue로 할 것인지 표준화되어 있지 않기 때문이다. 실제로 어떤 연구에서는 췌장 종양을 제외한 정상 췌장 실질(normal pancreatic parenchyma)을 reference tissue로 설정하였고[50,51], 췌장 주위 지방으로 추정되는 조직을 reference tissue로 설정한 연구도 있었다[49,52]. 또 다른 이유는 췌장 탄성 초음파가 가지는 검사 특성에 기인한다. 췌장은 복강 심부에 위치하고, 환자의 체형과 체위가 strain ratio를 측정하는 데 영향을 미칠 수 있다[53]. 이런 이유 등으로 인하여 strain ratio의 cut-off value는 연구마다 다르게 보고되고 있으며[49,50,52], 따라서 췌장 종양의 감별 진단에 있어서 탄성 초음파의 검사법이나 cut-off value를 표준화하기 위해서는 향후 추가 연구가 필요하다.
6) 방사형(radial) vs. 종주형(linear-array) EUS
EUS는 주사 방식에 따라 방사형 초음파와 종주형 초음파로 나뉘며, 주사 방식에 따라서 해부학적 orientation이 달라진다. 방사형 주사 방식은 내시경 선단에 위치한 초음파 탐촉자에서 내시경 종축에 직각 방향으로 360°의 원 모양으로 초음파가 발사되고 반사되어 돌아오는 초음파를 수집하여 영상을 만들어낸다. 방사형 초음파는 CT 영상과 유사한 해부학적 orientation을 나타내기 때문에 초심자들이 배우기에 비교적 쉬운 방법이라 할 수 있다. 하지만 세침 흡인을 위하여 주사침을 삽입하는 경우 초음파 영상에서 주사침이 하나의 점으로만 보이기 때문에, 주사침의 선단이 목표 조직 안에 들어가 있는지 확인을 할 수 없는 단점이 있다. 반면 종주형 주사 방식은 탐촉자에서 내시경 종축 방향의 절단면에 반원형으로 초음파가 발사되고 반사되어 돌아오는 초음파를 수집하는데, 주사하는 각도와 위치에 따라 해부학적 orientation의 많은 변화가 일어나기 때문에 익숙해지는 데 많은 시간이 걸린다. 시야가 좁고 초심자 입장에서 영상을 이해하는 데 어렵다는 단점이 있지만, 초음파 영상에서 주사침의 선단부를 온전하게 추적할 수 있기 때문에 EUS-FNA와 다른 중재적 시술이 가능하다는 장점이 있다. 방사형과 종주형 EUS 검사 중 어떤 것이 췌장암 진단에 더 우수한가를 직접 비교한 논문들은 많지는 않으나, 기존에 보고된 논문들의 결과를 간략히 살펴보고자 한다. 33명의 췌장암 환자를 대상으로 종주형과 방사형 EUS의 병기 결정에 대한 정확도를 전향적으로 비교한 연구[54]에 따르면, 수술 후 확인된 병기와 두 검사법의 병기의 정확도가 비슷하였다. 그러나 조직 검사의 필요성이 있는 경우 종주형 초음파가 탐촉자를 바꾸는 과정 없이 조직 검사까지 가능하였기 때문에 처음부터 종주형 방식의 초음파를 선호하였다. 증상이 없는 췌장암 고위험 환자(Peutz-Jegher syndrome, 췌장암 가족력 등) 278명을 대상으로 방사형과 주사형 방식의 초음파 내시경을 시행한 연구[55]에 따르면, 환자 1인당 병변의 소실률(lesion miss rate)은 종주형을 먼저 시행하고 방사형을 시행한 경우(4.5%) 보다 방사형을 먼저 시행하고 종주형을 나중에 시행한 경우 통계적으로 유의하게 더 높았다(9.8%). 그리고 Noh 등[56]은 Mayo Clinic에서 10년간의 EUS 검사 방식의 변화를 보고하였는데, EUS의 시행 횟수와 EUS-FNA의 시행 횟수가 10년간 지속적으로 증가하였고, 위장관 병변의 진단에는 방사형 주사 방식이 많이 사용되었으나 췌담도 병변의 경우에는 종주형 주사 방식의 초음파가 유의하게 많이 사용되었다. 방사형과 주사형 방식 중에 어떤 방식을 사용할 것인가는 시술자의 개인적 선호도, 숙련도에 따라 달라진다고 하겠다. 하지만 췌장을 검사하는 경우라면 췌장암같이 조직 검사가 필요한 경우가 많고, 췌장 거짓낭종(pseudocyst) 등에 대한 중재적 시술이 필요한 경우가 많으므로, 한 가지만 선택해야 하는 경우라면 종주형을 선택할 것을 권유한다.
7) 췌장암의 고위험군과 선별 검사로써 EUS의 역할
췌장암의 고위험군은 크게 (1) 역학적 고위험군(당뇨, 만성 췌장염 등); (2) 유전적 고위험군(가족성 췌장암, Peutz-Jegher Syndrome 등)으로 나눌 수 있다[57]. 만성 췌장염과 당뇨는 대표적인 역학적 고위험군이지만 미국 National Institutes of Health에서도 이에 해당하는 환자들에 대한 췌장암의 선별 검사를 공식적으로 운영하고 있지 않다. 하지만 당뇨를 새로 진단받은 50세 이상의 환자 1,561명을 후향적으로 추적한 결과, 3년 내에 췌장암의 발생 위험이 일반 인구 집단에 비하여 약 8배 증가하는 것으로 나타났다[58]. 또한 만성 췌장염 환자에서 췌장암 발생 위험을 조사한 메타 분석에 의하면[59], 만성 췌장염을 처음 진단받고 2년까지 췌장암의 발생 위험은 16배로 높다고 보고되었다. 이런 역학적 고위험군 환자를 대상으로 한 췌장암 선별 연구가 향후 필요할 것으로 보인다. 반면 전체 췌장암의 약 10%를 차지하는 유전적 고위험군에 대해서는 췌장암의 선별 검사에 대한 실험적인 연구가 이루어지고 있다. 췌장암의 유전적 고위험군이란 알려진 유전자 변이에 의하여 유전성 췌장암 증후군(inherited pancreatic cancer syndrome)을 앓거나 부모, 자녀, 형제, 자매 중 최소 2명이 췌장암을 진단받은 가족력이 있는 경우를 칭한다[54]. 췌장암의 선별 검사로써 혈청학적 표지자에 대해서는 많은 연구가 있었지만 아직까지 모두 임상적 유용성을 입증받지 못하였다[5]. 그래서 췌장암의 선별 검사는 영상학적 진단을 기반으로 하는데, 이때까지 시행된 췌장암 선별 검사에 대한 연구를 종합하여 보면, 대부분의 연구에서 1 cm 미만의 작은 췌장 종양을 발견하는 데 예민한 검사법인 EUS를 선별 검사의 도구로 사용하고 있다[60]. 무증상의 췌장암 고위험군 216명을 대상으로 한 췌장암 선별 검사 연구[61]에 따르면 EUS의 췌장 병변 발견율은 42.5%로, MRI (33.3%)와 CT (11%)보다 우월하였다. 그리고 북미에서 시행된 다기관 연구에 의하면 CT는 EUS나 MRI에 비하여 췌장 병변(특히 낭성 병변)을 발견하는 비율이 낮은 것으로 보고가 되었고[61] 방사능 피폭으로 인한 암 발생 가능성 때문에, CT는 췌장암 선별 검사의 도구로 적합하지 않다고 하였다. 검사 간격도 확실히 정립이 되지는 않았는데, 대부분의 전문가들은 췌장암의 유전적 고위험군에 해당하는 사람이 첫 번째 선별 검사에서 정상 췌장 소견을 보인다면 1년에 한 번씩 선별 검사를 할 것을 권유하고 있다[16].
결 론
췌장암의 생존율을 높이기 위해서는 조기 발견이 가장 중요한 과제이다. 따라서 췌장암의 조기 진단을 위해서 많은 연구가 이루어지고 있는데, 영상학적 진단 기법으로써 초음파 내시경이 높은 민감도로 주목받고 있다. 따라서 CT에서 췌관 확장이 있거나 황달, 종양 표지자 상승 등 임상적으로 췌장암이 의심되지만 CT에서 이를 설명할 수 있는 췌장 종양이 뚜렷하게 보이지 않는 경우에는 EUS를 반드시 고려해야 한다. 그리고 EUS는 다른 영상 진단 도구와 달리 영상을 보면서 실시간으로 조직 검사를 할 수 있다는 큰 장점이 있다. 또한 조영 증강 EUS를 이용하여, EUS로써만 감별이 힘든 췌장 종양의 감별에 도움을 받을 수 있다. 하지만 EUS를 능숙하게 다루기까지 내시경 의사의 경험이 많이 필요하며, 초음파 특성상 큰 종양의 경우 투과도의 한계로 인하여 심부 혈관과의 관계를 파악하기 어려운 단점도 있다. 따라서 EUS가 췌장암의 조기 발견에 있어서 우수한 진단 도구임은 틀림없지만 아직은 CT나 MRI 등 기존의 영상학적 기법과 상호보완적인 관계로 이해하여야 하며, 각각 영상학적 진단 도구의 장단점을 잘 파악하는 것이 중요하겠다.