Pancreas
Review Article Korean J Pancreas Biliary Tract 2022; 27(2): 81-89. Published online: April 30, 2022 급성 담관염의 진단과 치료Diagnosis and Treatment of Acute CholangitisCorresponding author : Tae Yoon Lee Department of Internal Medicine, Konkuk University School of Medicine, 120-1 Neungdong-ro, Gwangjin-gu, Seoul 05030, Korea Tel. +82-2-2030-8195 Fax. +82-2-2030-5029 E-mail; widebrow@empal.com
Copyright © 2022 by The Korean Journal of Pancreas and Biliary Tract This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits unrestricted noncommercial use, distribution, and reproduction in any medium, provided the original work is properly cited. 요약 급성 담관염은 담관의 폐색으로 인한 감염으로 발생하는 발열, 황달, 상복부 통증을 특징으로 하는 임상증후군이다. 중증에서는 정신혼미, 저혈압이 나타날 수 있으며 조기에 진단, 치료하지 않으면 치명적일 수 있다. 원인으로는 담관결석이 가장 흔하고 악성종양, 양성 담관 협착 순이며, 내시경역행담췌관조영술(ERCP) 후 불완전 담관배액에 의해 발생하는 담관염도 있다. 가장 흔한 원인균은 그람 음성균으로 E.coli, Klebsiella, Enterobacter 등이 있으며 한편 Enterococcus 는 가장 흔한 그람 양성균이다. 진단은 발열, 오한, 복통 등의 임상 증상 또는 백혈구, CRP 상승을 보이면서, 간기능 이상 또는 총빌리루빈 상승 등의 검사실 소견을 보이고, 복부 초음파 또는 복부 전산화단층촬영(CT) 등의 영상 검사에서 담관결석, 협착, 확장 같은 병변이 있으면 가능하다. 자기공명담췌관조영술(MRCP)과 내시경 초음파(EUS)는 초음파와 CT에서 진단이 불명확할 때 높은 정확도로 담관 폐색의 원인을 진단할 수 있다. 급성 담관염의 치료는 수액공급, 항생제, 담관배액술이 주가 된다. 경험적 항생제는 penicillin/β-lactamase 저해제, 제3세대 cephalosporin, carbapenem 계열 중 하나를 투여한다. 담관배액술은 급성 담관염의 모든 환자에서 필요한데 경증과 중등도의 담관염에서는 24-48시간 이내, 중증 담관염에서는 24시간 이내에 시행되어야 한다. 담관배액술의 방법으로는 ERCP가 가장 선호된다. 결론적으로 급성 담관염의 병태생리, 진단 및 치료에 대해서 잘 이해하는 것이 급성 담관염을 조기 진단해서 신속한 치료를 하는 데에 필수적이다.
Keywords: 담관염, 내시경역행담췌관조영술 AbstractAcute cholangitis is a clinical syndrome characterized by fever, jaundice, and abdominal pain that develops as a result of stasis and infection in the biliary tract. It can be a life-threatening condition if it is not recognized early. Patients with severe cholangitis may present with hypotension, and mental status changes. The most frequent causes of acute cholangitis are biliary calculi, benign biliary stricture, and malignancy. The most common pathogens isolated are gram-negative bacteria (Escherichia coli, followed by Klebsiella species and Enterobacter species). A diagnosis of acute cholangitis requires evidence of systemic inflammation, cholestasis, and imaging with biliary obstruction. Imaging studies may consist of ultrasound, computed tomography, magnetic resonance cholangiopancreatography, and/or endoscopic ultrasound. The mainstay of treatment consists of fluid resuscitation, antibiotics, and biliary drainage. Penicillin/β-lactamase, third-generation cephalosporin, or carbapenem are all acceptable choices for first-line treatment. In patients with severe cholangitis, biliary drainage should be performed within 24 hours. Patients with severe acute cholangitis require urgent (within 24 hours) biliary decompression. Endoscopic retrograde cholangiopancreatography remains the preferred modality for biliary drainage. In conclusion, acute cholangitis is mostly treatable when recognized and treated early. Recognizing and initiating early treatment leads to markedly decreased patient morbidity and mortality.
Keywords: Cholangitis, Cholangiopancreatography, endoscopic retrograde 서 론급성 담관염은 담관폐색으로 인한 감염으로 발생하는 발열, 황달, 상복부 통증을 특징으로 하는 임상증후군이다[1]. 남녀의 발생률이 같고 호발 연령은 50, 60대이다[2]. 내시경역행담췌관조영술(endoscopic retrograde cholangiography, ERCP) 도입 이전에는 사망률이 50%까지 보고되던 치명적인 질환이었으나 진단기법과 치료법의 발달로 인해 최근의 사망률은 10% 이하로 보고되고 있다[3]. 치료는 수액, 항생제 투여 및 담관배액이 필수적이다. 급성 담관염이 중요한 이유는 조기에 적절한 치료를 하면 비교적 높은 완치율을 보이지만 치료가 지연되면 사망률이 상승하기 때문이다. 본고에서는 급성 담관염의 임상 양상, 진단 및 치료에 대해 다루고자 한다.
본 론1. 원인과 위험인자급성 담관염의 원인으로는 담관결석이 반수 이상을 차지하며 다음으로 악성종양(담관암, 췌장두부암, 바터팽대부암 등), 양성 담관 협착(원발성 경화성 담관염, 급만성 췌장염 등) 순이며, 그 밖에 수술 후 담관 손상, 담관-장 문합 후 협착, ERCP에 의해 발생하는 담관염도 있다(Table 1) [4]. ERCP 후 발생하는 담관염은 1-5% 정도를 차지하고 담관의 불완전한 배액이나 담관 스텐트의 폐색에 의해 주로 발생하며, 만일 담관 협착의 위치가 간문부이고 다발성이며, 악성종양이 원인인 경우에는 위험도가 증가한다[5]. 최근의 후향적 연구에서 악성 간문부 담관협착에서 ERCP 시행 후 21.5%에서 급성 담관염이 발생하였음을 보고한 바 있고, Bismuth 4형과 플라스틱 스텐트 사용이 급성 담관염 발생의 독립적인 위험인자로 확인되었다[6]. 드문 원인으로는 십이지장 유두부 주위 게실로 인해 외부압박(Lemmel 증후군), Mirizzi 증후군 또는 담관내로 유입되는 기생충 등이 있다. 최근에는 오염된 십이지장경에서 생존하는 carbapenem-resistant Enterobacteriaceae 에 의한 급성 담관염이 문제가 된 바 있다[7].
2. 병태생리급성 담관염은 주로 담관 폐쇄 환자에서 세균감염에 의해 발생한다. 세균은 십이지장에서 담관으로 유입되며, 간문맥으로부터의 혈성전파는 드물다[8]. 담관으로의 세균 침입 방지기전으로 십이지장 역류 및 상행성 세균감염 방지에 효과적인 기계적 장벽 역할을 하는 오디괄약근이 있다. 또한 담즙의 지속적인 세척 관류(flushing) 작용과 담즙산염의 세균 억제 작용은 무균적 담즙 상태를 유지하는 데 도움이 된다. 또한 immunoglobulin A (IgA) 분비와 담관 점액은 세균의 군집을 막는 부착 방지 인자로 기능한다[2].
세균은 담관 폐색에 의해 정상적인 장벽 구조가 교란될 때 담관으로 침투할 수 있다. 이는 내시경 괄약근 절개술, 담관 수술, 담관 스텐트 삽입 후에 발생한다. 급성 담관염은 내시경 또는 경피적 담관배액술(percutaneous transhepatic biliary drainage, PTBD) 후 담관배액이 불완전한 경우 혹은 담관 스텐트의 폐색으로 인해 발생할 수도 있다. 담관 폐쇄는 담관 내압을 증가시키고 담관의 투과성을 증가시켜 문맥순환에서 담관으로 세균과 독소가 이동할 수 있도록 한다 [1]. 또한 담관 내압 상승은 담즙에서 전신 순환으로 세균의 이동을 초래하여 패혈증의 위험을 증가시킨다[8]. 또한 증가된 담관 압력은 Kupper 세포, 담즙 흐름, IgA 생성을 포함한 다수의 숙주 방어 기전에 악영향을 미친다.
3. 원인 균주급성 담관염에서 혈액 배양 양성률은 21-71%이지만 담즙, 결석이나 담관 스텐트를 배양하게 되면 90% 이상에서 균 양성으로 ERCP 시술 중에 이들 검체를 얻는 것을 권고한다[11]. 그람 음성과 양성 세균이 동정되고 이들은 대부분 대장에서 유래한 세균이다. 가장 흔히 동정되는 세균은 그람 음성균인 E.coli (25-50%)이며, 다음으로 Klebsiella (15-20%)와 Enterobacter(5-10%)가 있다(Table 2) [1]. 그람 양성균은 Enterococcus(10-20%)가 가장 흔하고 이들은 담관 스텐트에서 흔히 동정된다[12]. Bacteroides와 Clostridia 같은 혐기성균은 일반적으로 그람 양성균과 음성균과의 복합 감염으로 나타나고 담관 수술 후에 흔하다. 151명의 환자를 대상으로 한 최근의 후향적 연구에서 위절제술이 그람 양성균 출현과 관련이 있음을 보고하였다[13]. 드물게 Clonorchis sinensis, Opisthorchis viverrini 같은 기생충이 담관으로 유입되어 급성 담관염을 유발하기도 한다[14].
4. 임상 양상급성 담관염의 전형적인 증상은 발열, 복통 및 황달(Charcot’s triad)이지만 급성 담관염 환자의 50-75%만이 세 가지 증상을 모두 가지고 있다. 급성 담관염의 가장 흔한 증상은 발열과 복통으로 환자의 약 80%에서 볼 수 있고 황달은 환자의 60-70%에서 나타난다[15]. 발열, 복통, 황달 외에도 중증 담관염 환자는 저혈압과 의식저하(Reynolds pentad)가 동반될 수 있다. 저혈압은 노인이나 스테로이드 투여를 받는 환자에서 나타나는 유일한 증상일 수 있다. 급성 담관염 환자는 간농양, 패혈증, 다발성 장기부전, 쇼크 등의 합병증이 나타날 수도 있다. 신체 검진에서는 우상복부 압통과 복부 팽만, 빈맥이 나타날 수 있다.
5. 진단1) 2018 도쿄 가이드라인(Tokyo Guideline 2018)급성 담관염의 진단은 임상 양상, 혈액 검사 및 영상 소견으로 이루어진다. 급성 담관염은 우선 발열, 복통 및 황달(Charcot triad)이 있는 환자에서 의심해보아야 한다. 1877년에 제안된 Charcot triad는 특이도는 95%로 높지만 민감도는 26%로 낮다[16]. 이러한 문제점 때문에 급성 담관염에 대한 현대적인 진단 기준의 필요성이 대두되었고, 2007년 처음 발표된 도쿄 가이드라인과 2018년 개정된 도쿄 가이드라인은 현재 가장 널리 사용되는 진단 기준이다. 이 가이드라인은 임상 양상, 혈액 검사, 영상 검사 소견의 조합과 3단계의 중증도 평가로 구성되어 있다. 전신 염증 소견(발열 또는 혈액에서의 백혈구, C-reactive protein [CRP] 이상), 담즙 정체를 시사하는 검사실 소견 그리고 담관 확장 또는 원인 병소가 관찰되는 영상 검사, 이 세 가지가 모두 있을 때 확진이 가능하다(Table 3) [17]. 전신 염증 소견이 있고 담즙 정체와 영상 검사 소견 중 하나가 있을 때는 의심 진단으로 판단한다. 도쿄 가이드라인은 급성 담관염 진단에 있어 100%의 민감도와 87.4%의 특이도를 보인다[18].
2018 도쿄 가이드라인은 중증도를 3단계로 분류하였다(Table 4). 중증 담관염(등급 III)은 말단 장기 부전이 있는 경우이다. 중등도 담관염(등급 II)은 발열, 백혈구 수가 12,000/mm3 이상 또는 4,000/mm3 미만, 빌리루빈 5 mg/dL 이상, 저알부민(정상 상한치의 0.7배 이하) 또는 고령(75세 이상)일 때를 정의한다. 경증(등급 I)은 등급 II, III의 기준을 충족하지 않을 때이다. 경증인 경우 항생제 단독 치료에 반응을 보일 가능성이 높지만 중등도와 중증 담관염은 조기 담관배액이 필요하므로 중증도를 조기에 분류하는 것이 중요하다[19].
2) 검사실 소견급성 담관염 환자의 혈액 검사 소견은 일반적으로 백혈구, CRP 증가와 답즙 정체성의 간기능 검사 이상이 나타난다. 진단 확립 및 중증도 분류를 위한 검사실 평가에는 백혈구 및 혈소판 수치, 간기능 검사, 전해질, 지질, 프로트롬빈 시간 등이 포함된다. 혈액 배양은 담관염이 의심되는 모든 환자에게서 적절한 항생제 선택을 하게 도와준다. 2018 도쿄 가이드라인에서는 담즙과 스텐트에서도 배양 검사를 권고하고 있다[20].
급성 담관염 환자의 검사실 소견으로 백혈구 수가 증가하고 담즙 정체성 간기능 이상에 해당하는 혈청 알칼라인 포스파타제, 감마-글루타밀전이효소(gamma-glutamyltransferase), 빌리루빈 상승이 나타난다[15]. 가끔 아미노전이효소가 최대 2,000 IU/L까지 상승할 수 있는데, 이는 간의 미세농양 가능성을 시사한다[21]. 프로칼시토닌(procalcitonin)의 상승은 임상 악화의 위험성 및 긴급한 담관배액의 필요성을 시사하는 것으로 알려져 있다. 국내 연구에서 프로칼시토닌이 3.77 ng/mL 이상인 경우 임상적 악화와 관련이 있음을 보고하였다[22].
3) 영상과 내시경 검사급성 담관염의 영상 검사로는 복부 초음파, 복부 전산화단층촬영(computed tomography, CT), 자기공명담췌관조영술(magnetic resonance cholangiopancreatography, MRCP), 내시경 초음파(endoscopic ultrasonography, EUS)가 있다. 복부 초음파는 담관 확장 및 담관결석 진단에 있어 특이도는 높지만, 담관 확장 및 폐색 진단 민감도는 낮다[23]. 초음파는 중증 환자의 침상에서 수행할 수 있는 비침습적 검사라는 장점이 있으나 검사자에 의존적이며 담관결석이 작거나 아직 담관이 확장될 시간이 충분하지 않은 급성 폐색 시에는 음성으로 나올 수 있다.
복부 CT는 담관 확장 진단에 대한 민감도가 높고 담관 협착의 원인으로 담관암, 췌장암, 경화성 담관염 등을 감별할 수 있다. 급성 담관염에서는 간실질이 불균일하게 조영되는 것이 특징이다. 최근에 주로 사용하고 있는 나선형 CT는 담관결석에 대해 향상된 민감도(65-88%)와 특이도(73-97%)를 보여주고 있지만[24], 결석의 칼슘 함유량이 낮으면 CT에서 나타나지 않는 경우도 있어 주의를 요한다. 그러나 CT는 방사선 피폭의 위험이 있으며, 특히 조영제 알레르기가 있거나 신기능이 저하된 환자의 경우에는 주의를 요한다.
MRI/MRCP는 복부 초음파나 CT 검사에도 불구하고 진단이 불분명할 때 사용한다. MRCP는 조영제를 사용하지 않고도 담관을 명확히 관찰할 수 있으며 CT나 복부 초음파에 비해 담관 폐색 원인 파악에 있어 정확도가 높다[25]. 급성 담관염의 MRI 소견으로 T2 영상의 담관 주위의 신호 강도의 증가와 조영 증강 T1 영상에서 담관벽의 불균일한 조영증강이 있다[26].
EUS는 담관결석 진단에 있어 정확도가 높고(96.9%), CT나 MRCP에서 담관결석의 유무가 모호한 경우, 환자가 호흡 조절이 안 되거나 폐쇄공포증이 있어 MRCP를 시행할 수 없는 경우에 도움이 되며 ERCP와 같은 검사실에서 시행할 수 있다는 장점이 있다[1].
6. 합병증급성 담관염의 흔한 합병증으로 급성 췌장염(7.6%), 간농양(2.5%), 심내막염(0.26%) 등이 있다[11]. 또한 패혈증, 다발성 장기부전, 간문맥 혈전증, 위장관 출혈 또는 쇼크가 동반될 수 있다.
7. 치료급성 담관염의 치료는 수액공급, 항생제, 담관배액술이 주가 되는데 수액공급과 항생제 투여는 진단 즉시 시작하여야 한다[2]. 응고장애가 있는 경우 신선 동결 혈장이나 비타민 K를 투여한다.
2) 항생제 투여급성 담관염 환자에서는 초기 항생제 투여가 원칙이며, 경험적 항생제로 penicillin/β-lactamase 저해제, 3세대 cephalosporin, carbapenem, ampicillin/sulbactam 중 하나를 사용한다[20]. 항생제 선정에는 지역사회 획득 감염인지 병원 감염인지를 고려하고, 또한 환자 개인의 위험인자, 신기능, 간기능, 항생제 부작용을 고려한다[2]. 지역사회 획득 담관염이고 중환자실 입실이 필요 없는 환자는 piperacillin/tazobactam이 뛰어난 항균 효과를 보인다(Table 5) [1]. 동반 질환, 담관 협착, 반복적인 담관 시술 등의 위험인자가 있으면서 페니실린 내성 그람 음성균이 동정되는 경우에는 carbapenem 사용이 필요할 수도 있다[27]. 혈액과 담즙 배양이 조기에 맞춤 항생제 치료를 시작하는 데 있어 매우 중요하다.
2018 도쿄 가이드라인에서는 급성 담관염의 중증도에 따른 항생제 요법을 강조하고 있다. 등급 III의 지역사회 획득, 병원 획득 담관염에서는 항녹농균(pseudomonas) 작용이 있는 piperacillin/tazobactam, cefepime, ceftazidime, fluoroquinolone의 사용을 고려하고 Enterococci에 대한 vancomycin 사용도 고려한다(Table 6). Extended-spectrum beta-lactamase 생성 균주의 출현의 경우에는 추가적인 내성 발생 방지를 위한 항생제의 하향 조정(de-escalation)을 시행하는 것이 좋다[28].
항생제 투여 기간에 대해서는 가이드라인에 따라 3-10일로 다양하다[1]. 2018년 도쿄 가이드라인에서는 원발 병소가 충분히 제어되는 경우 항생제를 4-7일 투여하는 것을 권장하고 있다. Enterococci와 Streptococci의 경우 심내막염의 위험 때문에 항생제를 2주간 투여해야 한다[29]. 네덜란드의 최근 연구에서는 급성 담관염 환자에서 ERCP가 성공한 경우 항생제 투여는 3일이면 충분하다고 보고하였다[30]. 최근의 일본 연구에서도 성공적인 ERCP 후 항균제 투여를 3일 이내와 4일 이상군으로 비교하였을 때 두 군 모두 치료 결과에 차이가 없음을 보고하였다[31]. 급성 담관염의 항생제 투여 기간에 대해서는 현재 3개의 연구가 진행 중으로 결과가 주목된다[32].
3) ERCP급성 담관염 환자에서는 담관 내압 상승으로 인하여 항생제의 담관 내 침투가 제한적이므로 담관배액술이 필수적이다[2]. 담관배액의 이상적인 시행 시기는 확립되어 있지 않지만 증증 담관염에서는 24시간 이내의 응급 담관배액술을, 경증/중등도 담관염에서는 24-48시간 이내의 조기 담관배액술을 권고하고 있다[4]. 급성 담관염에서 ERCP의 시행 시기에 대한 후향적 연구를 보면 조기에 담관배액술을 시행한 경우(24-48시간 이내), 담관배액술이 지연된 경우와 비교할 때 유의하게 장기부전과 30일 사먕률이 감소되었고 재원기간이 단축되었다[33]. 최근의 메타분석에서도 유사한 결과를 보고하였다[34]. 유럽 가이드라인에서는 담관염으로 인한 패혈성 쇼크가 발생한 경우 12시간 이내에 ERCP를 권고하고 있다[35]. 담관배액술을 통해 급성 담관염의 원발 병소 제어가 가능해지고 이를 통해 담즙과 혈중 내독소 수치를 감소시키며, IgA와 항생제의 담관을 통한 배출이 촉진된다[1]. 담관배액이 신속히 이루어지면 발병 초기에 투여한 경험적 항생제의 감수성 여부와는 무관하게 30일 사망률, 중환자실을 포함한 재원 기간, 장기부전, 발열 지속 시간이 개선되는 것으로 나타났다[36]. 이는 즉각적인 담관배액술을 통한 병소의 제어가 배양 검사 결과를 근거로 한 항생제 투여보다 환자의 임상 결과에 더 큰 영향을 미친다는 것을 시사한다.
담관배액술의 가장 표준적인 방법은 ERCP이다. ERCP는 급성 담관염 환자 치료에 있어90% 이상의 성공률을 보인다. 시술 관련 합병증 발생률은 5% 정도이고 사망률은 1% 미만이다[1]. ERCP를 통해 담즙을 채취하여 배양 검사를 할 수 있고 담관 괄약근 절개술, 담관 스텐트 유치, 경비 배액관 유치를 통해 담관 폐색을 치료하게 된다. 또한 담관결석이 있으면 동시에 제거가 가능하다. 다만 담관결석으로 인한 급성 담관염 환자의 경우 담관결석 제거 후 남은 결석 확인을 위한 풍선 폐색 담관 조영술은 담관성 패혈증을 악화시킬 수 있으므로 피하는 것이 좋고, 환자의 상태가 장시간의 시술을 견딜 수 없는 경우에는 담관결석 제거는 추후로 미루고 담관 스텐트만 삽입하는 것도 적절한 대안이다.
ERCP에 대한 유일한 절대 금기는 시술 전 장관천공이 의심될 때이다. 심폐기능부전, 응고장애, 임신, 심한 조영제 알레르기 등은 상대적 금기사항이며 응고장애 환자에서 시술 전 교정이 불가능한 경우 담관 괄약근 절개술을 시행하지 않는 것이 좋다. 응고장애가 있거나 거대 담관결석이 있는 경우, 환자가 고령이고 전신상태가 불량한 경우에는 담관 괄약근 절개술을 하지 않고 담관 스텐트 혹은 경비배액관을 우선 삽입하는 것이 출혈 등의 시술 후 합병증을 예방하는 데 도움이 된다[37].
4) PTBDPTBD는 ERCP가 실패한 경우, 기저 질환이 다수인 환자, 수술로 인한 해부학적 변이로 ERCP가 어려운 환자에서 2차적인 치료로 시행한다. PTBD는 진정약물이 필요 없고 똑바로 누운 상태에서 시행할 수 있기 때문에 혈역학적으로 불안정한 환자에서 ERCP보다 안전하다. 또한 담관 폐색 부위가 총담관보다 상방인 경우 또는 간의 구역 배액이 필요한 경우에도 효과적인 시술이다[38]. 단점은 간내 담관 확장이 있어야 시행할 수 있다는 것이고 ERCP와 비교할 때 재원 기간이 증가되고, 합병증으로 튜브로 인한 통증 및 불편감, 복강내 출혈, 담즙성 복막염, 패혈증 등이 발생할 수 있다는 점이다. 금기증으로는 응고장애, 복수, 간내 담관 폐색을 들 수 있다[2].
5) EUS 유도하 담관배액술최근 10년간 EUS 유도하 담관배액술이 발전하여 ERCP가 불가능하거나 실패한 환자에서 대안으로 시행하고 있다. EUS 유도하 담관배액술은 좌측 간내담관과 위장을 연결하는 시술(hepaticogastrostomy), 총담관과 십이지장을 연결하는 시술(choledocho-duodenostomy) 및 유도선을 십이지장으로 내려서 ERCP를 시행할 수 있도록 도와주는 랑데뷰 시술(Rendezous) 등이 시행되고 있다.
6) 수술적 치료수술적 치료는 ERCP, PTBD, EUS를 통한 배액술이 모두 실패한 경우 마지막 방법으로 고려할 수 있다. 담낭 담석이 있는 경우 복강경 담낭절제술을 시행 후 절개한 담낭관을 통한 담관 접근 및 담관결석 제거가 가능하다[38].
8. 예후ERCP가 도입되기 전 1970년대의 급성 담관염의 사망률은 50%를 상회하였으나 최근의 연구에서는 사망률이 10% 이하로 보고되고 있다[11]. 저알부민혈증, 프로칼시토닌 상승(0.5 ng/mL 이상), IL-7 상승(6 pg/mL 이상)이 높은 사망률과 연관이 있다[33,39]. 비만도 높은 사망률과 연관이 있는 것으로 보고되었다[40]. 최근에 급성 담관염의 사망률은 많이 낮아졌지만 30일 재입원율은 21%로 상대적으로 높다. 재입원의 원인으로 담관염의 재발, 패혈증, 스텐트 폐색 등이 있다. 재입원율은 담낭절제술이나 ERCP를 시행한 환자에서 낮고 PTBD를 시행한 환자에서 높은 것으로 보고되었다[41].
REFERENCES1. An Z, Braseth AL, Sahar N. Acute cholangitis: causes, diagnosis, and management. Gastroenterol Clin North Am 2021;50:403-414.
3. Miura F, Takada T, Kawarada Y, et al. Flowcharts for the diagnosis and treatment of acute cholangitis and cholecystitis: Tokyo Guidelines. J Hepatobiliary Pancreat Surg 2007;14:27-34.
4. Kimura Y, Takada T, Kawarada Y, et al. Definitions, pathophysiology, and epidemiology of acute cholangitis and cholecystitis: Tokyo Guidelines. J Hepatobiliary Pancreat Surg 2007;14:15-26.
5. Chen M, Wang L, Wang Y, et al. Risk factor analysis of post-ERCP cholangitis: a single-center experience. Hepatobiliary Pancreat Dis Int 2018;17:55-58.
6. Xia MX, Wang SP, Wu J, et al. The risk of acute cholangitis after endoscopic stenting for malignant hilar strictures: a large comprehensive study. J Gastroenterol Hepatol 2020;35:1150-1157.
7. Epstein L, Hunter JC, Arwady MA, et al. New Delhi metallo-β-lactamase-producing carbapenem-resistant Escherichia coli associated with exposure to duodenoscopes. JAMA 2014;312:1447-1455.
8. Sung JY, Costerton JW, Shaffer EA. Defense system in the biliary tract against bacterial infection. Dig Dis Sci 1992;37:689-696.
9. Csendes A, Becerra M, Burdiles P, Demian I, Bancalari K, Csendes P. Bacteriological studies of bile from the gallbladder in patients with carcinoma of the gallbladder, cholelithiasis, common bile duct stones and no gallstones disease. Eur J Surg 1994;160:363-367.
10. Ohdan H, Oshiro H, Yamamoto Y, et al. Bacteriological investigation of bile in patients with cholelithiasis. Surg Today 1993;23:390-395.
11. Gomi H, Takada T, Hwang TL, et al. Updated comprehensive epidemiology, microbiology, and outcomes among patients with acute cholangitis. J Hepatobiliary Pancreat Sci 2017;24:310-318.
12. Lübbert C, Wendt K, Feisthammel J, et al. Epidemiology and resistance patterns of bacterial and fungal colonization of biliary plastic stents: a prospective cohort study. PLoS One 2016;11:e0155479.
13. Jo IH, Kim YJ, Chung WC, et al. Microbiology and risk factors for gram-positive Cocci bacteremia in biliary infections. Hepatobiliary Pancreat Dis Int 2020;19:461-466.
14. Xia J, Jiang SC, Peng HJ. Association between liver fluke infection and hepatobiliary pathological changes: a systematic review and meta-analysis. PLoS One 2015;10:e0132673.
15. Mosler P. Diagnosis and management of acute cholangitis. Curr Gastroenterol Rep 2011;13:166-172.
16. Rumsey S, Winders J, MacCormick AD. Diagnostic accuracy of Charcot’s triad: a systematic review. ANZ J Surg 2017;87:232-238.
17. Kiriyama S, Kozaka K, Takada T, et al. Tokyo Guidelines 2018: diagnostic criteria and severity grading of acute cholangitis (with videos). J Hepatobiliary Pancreat Sci 2018;25:17-30.
18. Takada T. Tokyo Guidelines 2018: updated Tokyo Guidelines for the management of acute cholangitis/acute cholecystitis. J Hepatobiliary Pancreat Sci 2018;25:1-2.
19. Miura F, Okamoto K, Takada T, et al. Tokyo Guidelines 2018: initial management of acute biliary infection and flowchart for acute cholangitis. J Hepatobiliary Pancreat Sci 2018;25:31-40.
20. Gomi H, Solomkin JS, Schlossberg D, et al. Tokyo Guidelines 2018: antimicrobial therapy for acute cholangitis and cholecystitis. J Hepatobiliary Pancreat Sci 2018;25:3-16.
21. Attasaranya S, Fogel EL, Lehman GA. Choledocholithiasis, ascending cholangitis, and gallstone pancreatitis. Med Clin Nor th Am 2008;92:925-960.
22. Lee YS, Cho KB, Park KS, Lee JY, Lee YJ. Procalcitonin as a decisionsupporting marker of urgent biliary decompression in acute cholangitis. Dig Dis Sci 2018;63:2474-2479.
23. Pasanen PA, Partanen KP, Pikkarainen PH, Alhava EM, Janatuinen EK, Pirinen AE. A comparison of ultrasound, computed tomography and endoscopic retrograde cholangiopancreatography in the differential diagnosis of benign and malignant jaundice and cholestasis. Eur J Surg 1993;159:23-29.
24. ASGE Standards of Practice Committee, Maple JT, Ben-Menachem T, et al. The role of endoscopy in the evaluation of suspected choledocholithiasis. Gastrointest Endosc 2010;71:1-9.
25. Pai PG, Menezes V, Subramanian AM, Shenoy JP. Medical students’ perception of their educational environment. J Clin Diagn Res 2014;8:103-107.
26. Eun HW, Kim JH, Hong SS, Kim YJ. Assessment of acute cholangitis by MR imaging. Eur J Radiol 2012;81:2476-2480.
27. Kruis T, Güse-Jaschuck S, Siegmund B, Adam T, Epple HJ. Use of microbiological and patient data for choice of empirical antibiotic therapy in acute cholangitis. BMC Gastroenterol 2020;20:65.
28. Buckman SA, Mazuski JE. Review of the Tokyo Guidelines 2018: antimicrobial therapy for acute cholangitis and cholecystitis. JAMA Surg 2019;154:873-874.
29. Chandra S, Klair JS, Soota K, Livorsi DJ, Johlin FC. Endoscopic retrograde cholangio-pancreatography-obtained bile culture can guide antibiotic therapy in acute cholangitis. Dig Dis 2019;37:155-160.
30. Haal S, Ten Böhmer B, Balkema S, et al. Antimicrobial therapy of 3 days or less is sufficient after successful ERCP for acute cholangitis. United European Gastroenterol J 2020;8:481-488.
31. Satake M, Yamaguchi Y. Three-day antibiotic treatment for acute cholangitis due to choledocholithiasis with successful biliary duct drainage: a single-center retrospective cohort study. Int J Infect Dis 2020;96:343-347.
32. Haal S, Wielenga MCB, Fockens P, et al. Antibiotic therapy of 3 days may be sufficient after biliary drainage for acute cholangitis: a systematic review. Dig Dis Sci 2021;66:4128-4139.
33. Aboelsoud M, Siddique O, Morales A, Seol Y, Al-Qadi M. Early biliary drainage is associated with favourable outcomes in critically-ill patients with acute cholangitis. Prz Gastroenterol 2018;13:16-21.
34. Iqbal U, Khara HS, Hu Y, et al. Emergent versus urgent ERCP in acute cholangitis: a systematic review and meta-analysis. Gastrointest Endosc 2020;91:753-760.e4.
35. Manes G, Paspatis G, Aabakken L, et al. Endoscopic management of common bile duct stones: European Society of Gastrointestinal Endoscopy (ESGE) guideline. Endoscopy 2019;51:472-491.
36. Kawamura S, Karasawa Y, Toda N, et al. Impact of the sensitivity to empiric antibiotics on clinical outcomes after biliary drainage for acute cholangitis. Gut Liver 2020;14:842-849.
37. Hui CK, Lai KC, Yuen MF, et al. Does the addition of endoscopic sphincterotomy to stent insertion improve drainage of the bile duct in acute suppurative cholangitis? Gastrointest Endosc 2003;58:500-504.
38. Navuluri R, Hoyer M, Osman M, Fergus J. Emergent treatment of acute cholangitis and acute cholecystitis. Semin Intervent Radiol 2020;37:14-23.
39. Suwa Y, Matsuyama R, Goto K, et al. IL-7 and procalcitonin are useful biomarkers in the comprehensive evaluation of the severity of acute cholangitis. J Hepatobiliary Pancreat Sci 2017;24:81-88.
Fig. 1.Endoscopic and fluoroscopic images of acute cholangitis. (A) Purulent bile from the duodenal papilla was noted. (B) A black-pigmented stone was extracted. (C) A small stone was noted at the mid common bile duct (arrow). 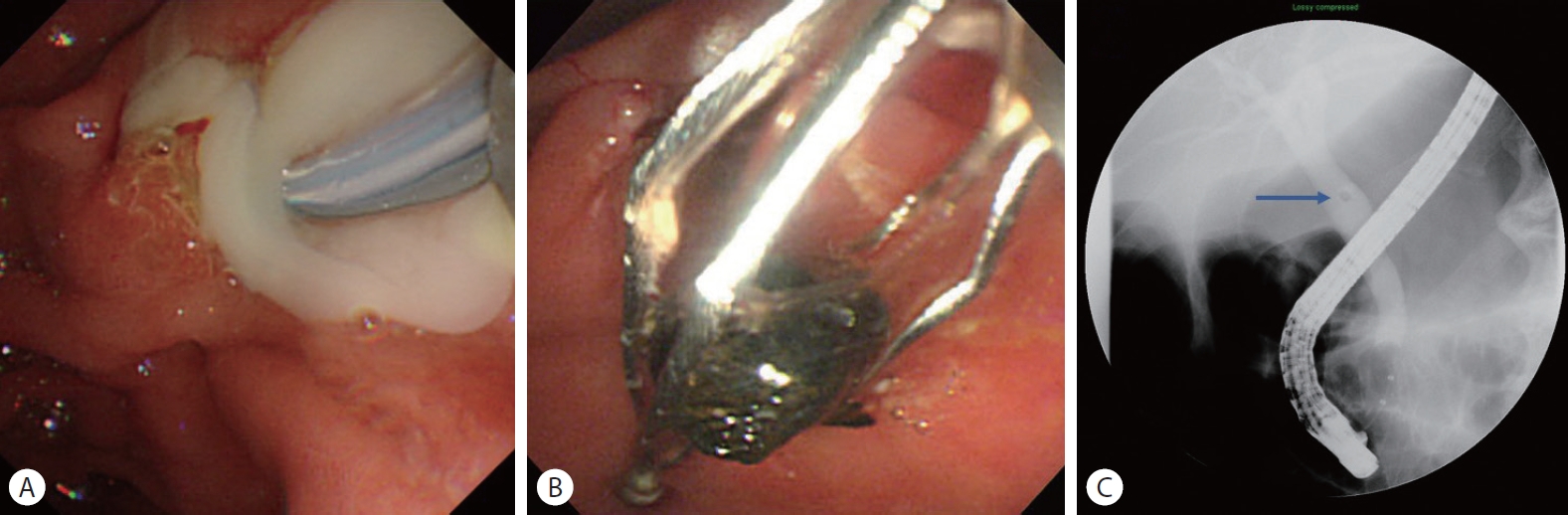
Table 1.Causes of acute cholangitis Table 2.Most common pathogens in acute cholangitis Table 3.Tokyo Guideline 2013/2018 diagnostic criteria Table 4.Tokyo Guideline 2013/2018 severity criteria Table 5.Empiric antibiotic regimens for low-risk community-acquired intra-abdominal infections
Table 6.Empiric antibiotics for high-risk community-acquired or health care associated intra-abdominal infections |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||











