서 론
췌장 낭성 종양의 유병률은 2.6-15%로 나이가 들면서 증가하여 80세 이상에서는 37%까지 보고되고 있다[1,2]. 췌장 낭종 중 하나인 췌관내유두상점액종양(intraductal papillary mucinous neoplasms, IPMN)은 전암성 병변으로 인식된다. IPMN은 그 위치에 따라 주췌관형(main duct, MD), 혼합형(mixed), 분지형(branch duct, BD)으로 구분된다(Fig. 1). 문헌 고찰에 따르면, 영상검사에서 BD-IPMN으로 수술받은 환자 중 악성 IPMN은 11-30%로 보고되었다[3-5]. MD-IPMN의 췌장암 발생 위험도는 BD-IPMN보다 높으며, 수술한 환자를 대상으로 한 연구에서는 62%까지 악성 IPMN이 보고되었다[6-8]. 췌장 IPMN 병변과 떨어진 다른 부위에 췌장선암 발생율이 높다는 보고가 있어 주의 깊은 추적 관찰이 필요하다[9-11].
최근 진료지침들은 IPMN병변의 특징에 따라 ‘고위험군(high risk stigmata, HRS)’과 ‘우려되는 특징(worrisome feature, WF)’ 등으로 분류하여 치료방향을 설정할 것을 권고하였다. HRS를 가진 IPMN은 거의 모든 진료 지침에서 수술의 절대적 적응증으로 분류하였다. 그러나 WF을 가진 환자들의 경우 수술의 상대적 적응증에 해당되었고, 연구에 따라서는 WF 환자에서 기존 가이드라인에 따라 치료 방향을 결정하면 불필요한 수술이 증가할 수 있다. 따라서 실제 임상에서 IPMN 환자를 추적 관찰하는 방법과 악성화 위험도가 높은 환자를 선별하는 전략이 매우 중요하지만 아직도 어려운 숙제이다. 본고에서는 소화기내과 의사 관점에서 본 HRS 또는 WF를 가진 IPMN의 추적 관찰 및 치료 전략 등에 대하여 알아보고자 한다.
본 론
1. 췌장 IPMN의 진료지침
다수의 후향적 연구 결과와 전문가들의 의견을 바탕으로 정립된 다양한 진료지침들에서 IPMN의 적절한 치료 및 추적 관찰 전략을 제시하고 있다. 실제 임상에서는 국제췌장 학회(International Association of Pancreatology, IAP)의 2017년 진료지침과 2018년 유럽진료지침(European evidence-based guidelines on pancreatic cystic neoplasms)이 주로 적용되고 있다(Table 1) [12,13]. 이 진료지침들은 악성화 위험인자 및 치료전략, 관리전략 등의 항목을 서술하고 있으며 비교적 유사한 전략을 제시하고 있으나 수술의 적응증, 추적 관찰전략에 대해 다소간의 차이가 있는 부분도 있다. 각 지침들은 자기공명영상촬영(magnetic resonance image, MRI) 또는 전산화 단층촬영(computed tomography, CT) 소견 등에 따라 악성화를 시사하는 고위험군의 기준과 수술의 적응증 등을 제시하고 있다(Table 1).
2017년 IAP 진료지침은 환자의 임상 증상과 영상 소견을 바탕으로 HRS와 WF으로 구분하여 추적 관찰과 치료전략을 권고하고 있다[12]. 수술이 필요한 소견으로 판단되는 HRS에는 췌장 두부의 낭종으로 인해 발생된 폐쇄성 황달, 낭종 내부에 조영 증강된 5 mm 이상의 고형 종괴, 주췌관의 10 mm 이상 확장이 포함된다. WF에는 IPMN으로 인한 급성췌장염의 기왕력, 3 cm 이상의 낭종, 두껍게 조영증강되는 낭종벽, 5-9 mm 확장된 주췌관, 5 mm 이내의 조영증강 고형 종괴, 췌장의 위축과 동반된 주췌관의 급격한 확장, 림프절 비대, carbohydrate antigen 19-9 (CA 19-9) 상승, 2년에 5 mm 이상의 낭종 크기 증가 등이 해당된다. 또한, 병변의 크기에 따라 추적관찰 간격과 영상검사 방법을 다르게 하되, 환자의 나이, 가족력, 동반질환 여부, 췌장암 발생 위험도, 환자의 선호도 등을 종합적으로 고려할 것을 권고하였다.
2018년 유럽진료지침에서는 IAP 지침의 HRS/WF에 상응하는 수술의 절대적 적응증 및 상대적 적응증을 제시하였다. 수술의 절대적 적응증으로 IAP 지침 HRS에 세포검사에서 악성 또는 고이형성 소견, 췌장 고형 종괴을 추가하여 제시하였다[13]. 수술의 상대적 적응증으로는 주췌관 5-9 mm 확장, 5 mm 미만의 조영증강 낭종내 결절, 40 mm 이상의 낭종, 1년에 5 mm 이상의 낭종 크기 증가, IPMN에 의한 급성 췌장염 발생, 새롭게 생긴 당뇨, CA 19-9 (>37 U/mL) 상승 등이 해당된다. 주목할 부분은 수술의 상대 적응증의 낭종 크기 기준이 4 cm 이상으로 IAP 지침에서의 3 cm 이상과 차이를 보이며, 최근 진단된 당뇨병이 포함되어 있다는 점이다. 심각한 기저질환이 있는 환자의 경우 한 개의 상대적 적응증이 있는 경우에는 면밀한 추적 관찰을 권고하였으나, 2개 이상의 상대적 적응증이 있을 때는 수술을 권고하였다.
2017년 개정된 IAP가 제시한 악성 위험 인자들은 전문가들의 의견과 IPMN으로 수술한 환자들을 대상으로 한 후향적 연구 등에 기반을 두어 설정되었다. Ohtsuka 등[14]의 후향적 연구에서 “HRS, WF”, 저위험군에 따른 악성 IPMN의 빈도는 각각 61%, 26%, 0%로 보고하였다[12]. 또한, HRS가 있는 IPMN 환자에서 악성 IPMN과 침윤성암(invasive carcinoma)의 빈도는 각각 80%, 55%였고, 위험인자가 많을수록 악성도는 증가하였다[15]. 또한, 최근 4개의 보고에 의하면 HRS를 가진 환자들 중 56-75%가 악성이었고, WF를 가진 환자들 중 27-40%가 악성이었다[16-19]. 단일 HRS와 WF에 대한 악성 위험도는 각각 65%, 2-30%로 현저한 차이가 있다[16,17]. 저위험군 BD-IPMN 2,177명이 포함된 메타 분석에서 악성종양 발생율은 3.7%였고 IPMN과 연관이 없는 췌장선암 발생율은 1.3%였다고 보고하였다[20]. 따라서 WF나 HRS가 없는 BD-IPMN은 비수술적 치료가 필요하지만 췌장선암 발생 가능성이 있어 장기적인 추적 관찰이 필요하다.
2. High risk stigmata와 worrisome feature의 추가적 평가
진료지침의 HRS와 WF 중 하나인 췌장 낭종내 종양성 결절은 악성 IPMN을 시사하는 가장 강력한 영상 소견으로 절대적 수술적응증이다[21,22]. 초음파내시경(endoscopic ultrasound, EUS)과 MRI 검사가 낭종내 결절의 진단에 매우 우수하다[23]. Zhong 등[24]은 낭종내 종양성 결절 진단율에서 EUS가 조영증강 CT보다 탁월하다고 보고하였다(75% vs. 25%). Kim 등[25]은 BD-IPMN에 관한 다기관 후향적 연구에서 EUS에서 관찰되는 종양성 결절이 악성을 예측할 수 있는 의미있는 인자이고, CT에서 관찰되지 않은 결절이 EUS에서 82례 중 6례(7.3%)에서 관찰되었다고 보고하였다. 이 6례 중 2례는 악성 IPMN으로 확인되었다.
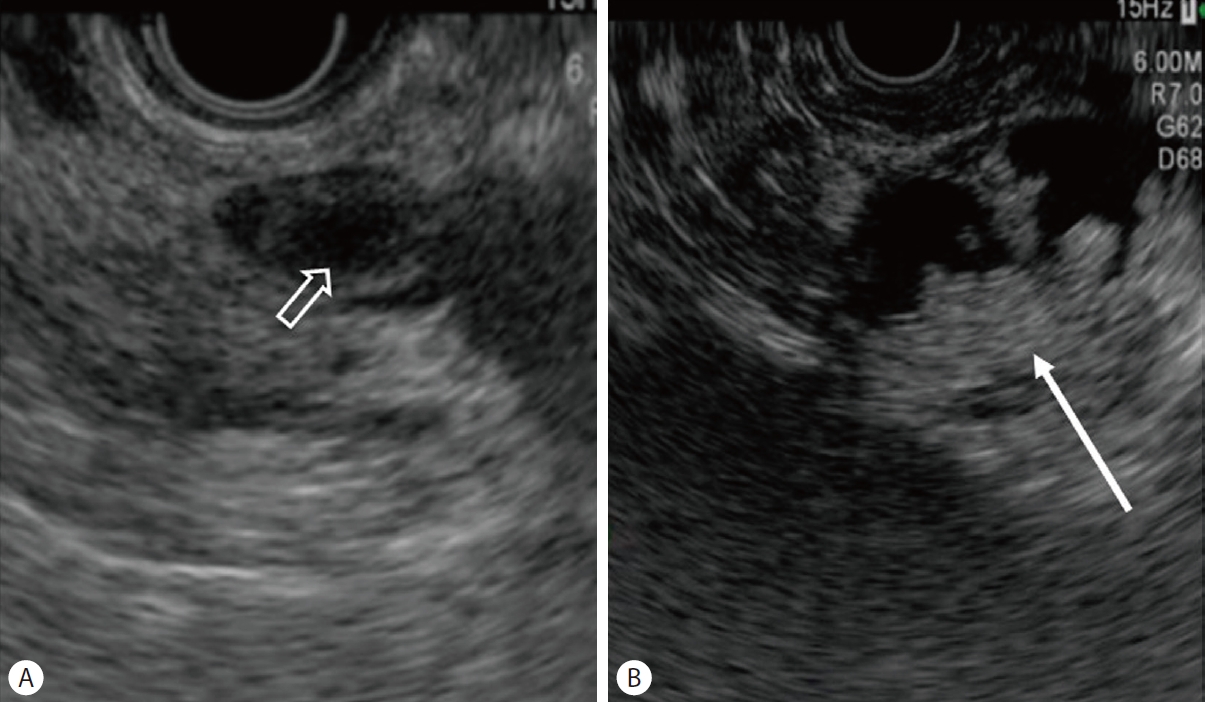
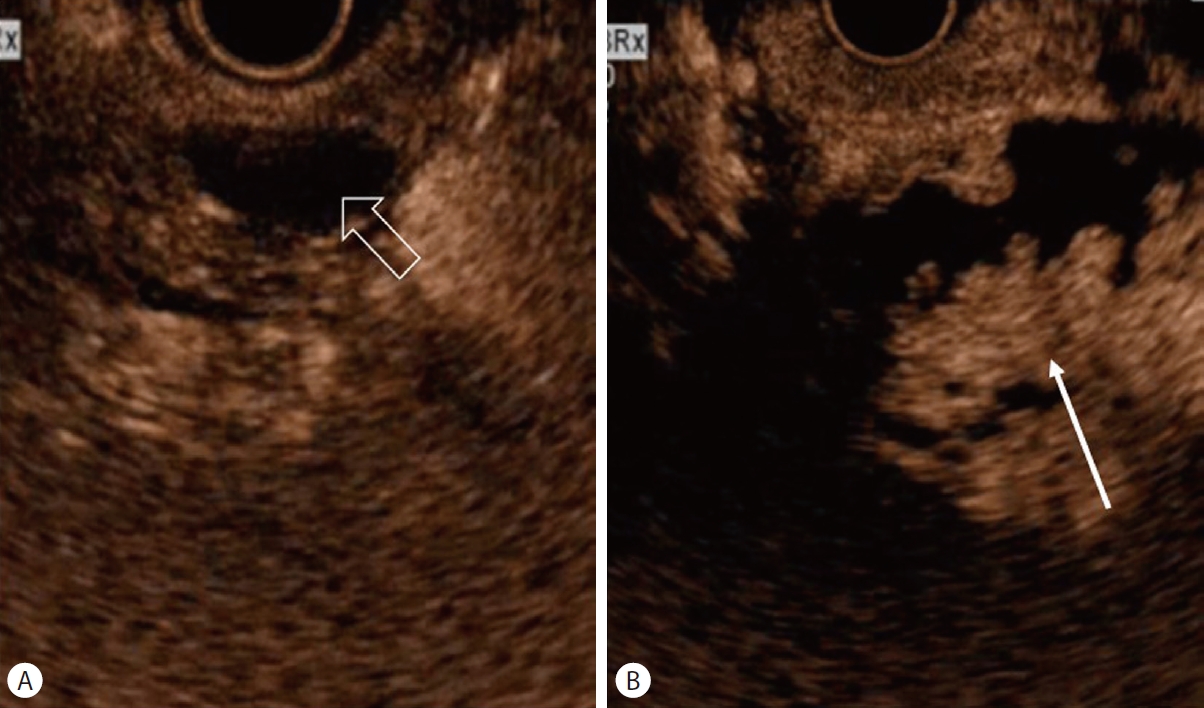
조영 증강 MRI는 확산 강조 영상(diffusion weighted image)이 추가되면서 종양성결절의 진단의 정확도가 높아졌다. D'Onofrio 등[26]은 조영증강 MRI로 낭종 내 5 mm 이상 결절의 진단율이 89%였다고 보고하였다. 낭종내 종양성 결절과 점액성 결절과 감별은 IPMN 치료 전략에 매우 중요하다. EUS의 B-mode 영상에서 종양성 결절은 불규칙적인 경계와 고에코 중심이 관찰되며, 점액공(mucin ball)일 경우 주변 실질과 비교하여 매끈하고 잘 경계가 지어지는 고에코 테두리와 저에코 중심이 관찰되어 감별할 수 있다(Fig. 2) [24]. 그러나 B-mode 영상에서도 종양성 결절과 점액공을 감별하기 어려울 때는 조영증강 EUS가 결절의 감별진단에 유용한 검사로 제시되었다. 종양성 결절은 조영증강 EUS에서 잘 조영되고 비종양성 결절은 조영증강이 되지 않는다(Fig. 3). 조영증강 초음파내시경을 이용한 췌장 낭종내 종양성 결절의 특징을 분석한 체계적 검토와 메타 분석에서 민감도와 특이도는 각각 97%와 90.4%였고, 진단 정확도는 95.6%였다[27]. 또한, 다른 보고에서는 5 mm 이상의 낭종내 조영증강 종양성 결절의 크기를 악성 낭종을 시사하는 유용한 예측인자로 제시하였다[23].
MRI 또는 CT 후 WF가 발견된 경우 추가 평가전략은 지침별로 다소간의 차이가 있으나 현재까지 대부분의 진료지침은 EUS 또는 EUS 유도하 세침흡인검사(EUS-fine needle aspiration, EUS-FNA)로 낭액을 채취하여 낭액 내의 CA 19-9, carcinoembryonic antigen, glucose, GNAS mutation 유무, KRAS mutation 유무, 세포진검사 등을 추천하고 있다. EUS-FNA를 통한 세포 검사는 확진이 가능한 검사이지만 검체 내 세포 수가 적어서 진단의 민감도가 매우 낮고, 악성 병변의 진단에 있어서는 민감도 25-88%, 특이도 83-99%로 다양하게 보고된다[28-30].
췌장 낭종의 조직학적 검사를 위해서 EUS 유도하 19G 세침에 미세조직겸자(microforcep)를 삽입하여 조직 검사가 시행될 수 있다(EUS-guided through the needle biopsy, EUS-guided TTNB). 여러 연구들에서 EUS-guided TTNB의 췌장 낭성 종양의 진단율이 61.9-88.9%로 시술 연관 합병증 발생율은 3.6-22.9%로 보고하였다[31-33]. 이 시술의 합병증으로는 급성 췌장염, 낭종내 출혈 등이 보고되었다[31-34]. 메타분석에서 EUS-guided TTNB의 적절한 조직 채취율 85.3%, 진단율 78.8%, 민감도 82.2%로 EUS-FNA에 비하여 의미 있게 높았다[35]. 최근에 Cho 등[36]의 45명을 대상으로 한 EUS-guided TTNB 연구에서 조직학적 진단율은 82%였고, IPMN이 가장 많았고 저등급 이형증 14례, 고도 이형성증(high grade dysplasia, HGD) 1례, 이형성증이 확인이 안된 증례 3례였다고 보고하였다. 이 시술은 점액성 종양과 비점액성 종양의 감별에 우수한 성적을 보였다. 그러나 이 미세 조직검사가 낭종 전체의 조직학적 등급을 정확하게 반영할 수 있는지에 대한 의문이 남아있고, 합병증 발생과 이 시술의 적응증에 관한 많은 연구가 필요하다.
3. 악성 위험 인자들의 악성도 차이와 역동적 변화의 중 요성
WF와 HRS의 각각의 요소들은 다른 악성 위험도를 가질 수 있고, 이러한 위험요소들이 중복되는 경우 IPMN의 악성도가 높을 수 있다[18,37,38]. 악성 IPMN은 일반적으로 HGD, 침윤성 암종(invasive carcinoma IC)을 포함한다. IC의 나쁜 예후와 췌장 절제술 합병을 고려할 때 수술적으로 가장 적절한 단계는 HGD 단계이다[39]. Izumo 등[40]은 HGD를 예측할 수 있는 주요인자로 5 mm 이상의 조영 증강 결절, 췌장염, 두꺼운 낭종벽을 제시하였다. 또한, 이들은 악성 위험인자의 위험도에 따라서 5 mm 이상 크기의 조영증강결절을 2점, 췌장염과 두꺼운 낭종벽을 1점으로 배정하여 췌장낭종의 위험요소들을 점수화하였다[40]. 이 연구에서 HGD 발생률은 0점 9%, 1점 26%, 2점 52%, 3점 62%, 4점 63%였다.
Zelga 등[41]은 IPMN으로 수술한 810명의 환자들에서 WF (370명) 또는 HRS (379명)의 수에 따라서 악성도를 분석하였다. HRS과 WF를 가진 환자군에서 악성 종양은 각각 70% (n=267)와 30% (n=127)였고, 악성종양 위험율은 WF가 1개, 2개, 3개, 4개 일 때, 각각 22%, 34%, 59%, 100%로 단계적으로 증가하였다[41]. Marchegiani 등[42]은 췌장 낭종 환자들을 추적 관찰 중 수술적 절제가 시행되어 조직학적 확인이 되었던 IPMN 증례 292명을 대상으로 다기관 연구를 시행하였다. 이 연구에서는 추적 기간 중에 발생하는 WF와 HRS의 역동적인 변화에 따라서 7개의 패턴으로 구분하여 악성위험도를 분석하였다. 추적 관찰 중 WF 또는 HRS가 발생하지 않거나 WF가 변화가 없을 때, WF가 발생하였을 때는 악성화 위험성이 낮았다. 그러나 추가적으로 WF가 발생하거나 HRS가 발생하였을 때, WF에 HRS가 추가되었을 때는 단계적으로 악성화 위험성이 높아졌다. 이 연구는 IPMN 환자들의 추적 관찰 중 WF와 HRS 변화를 잘 관찰하는 것이 매우 중요함을 보여주고 있다.
4. 주췌관 침범 IPMN의 치료 전략
주췌관을 침범하는 IPMN 악성화 위험도는 36-90%, IC의 발생률은 11-81%로 보고되고 있다[12]. 2017년 개정된 IAP 지침과 2018년 European 지침 모두에서 MD-IPMN와 Mixed-IPMN의 경우 높은 악성화 위험도로 인해 수술적 절제를 권고하고 있다[12,13]. 그러나 MD-IP은 대부분 확실한 낭종내 결절이나 고형성 종괴, 주췌관이 10 mm 이상 확장, 증상이 동반된 환자들이 포함되어 있어 악성화 위험도를 평가할 때 선택 편향(selection bias)이 내재되어 있다[6,43-47].
주췌관의 확장은 IPMN에 의한 주췌관 침범뿐만 아니라 BD-IPMN에서 만들어진 점액덩어리, 만성 췌장염, 작은 췌장선암종, 췌장내분비종양 등에 의해서도 발생될 수 있다. Crippa 등[48]은 주췌관이 5-9 mm로 확장되어 있으나 다른 HRS가 없는 무증상 환자의 경우에는 악성화 위험성이 낮다고 보고하였다. 이와 반대로, Hackert 등[49]은 주췌관이 5-9 mm로 확장된 수술 환자의 59%에서 악성화 위험이 관찰되었기 때문에 수술의 적응증을 주췌관 5 mm 이상의 확장으로 낮출 것을 제안하였다. Kim 등[7]은 조영 증강되는 벽결절이 관찰되지 않은 MD와 Mixed-IPMN으로 수술받은 국내 환자들에서 임상적 특성과 췌장의 형태학적 특징을 분석하였다. 이 연구에서 분절형 주췌관 확장과 주췌관이 5-9 mm로 확장된 경우가 그렇지 않은 경우와 비교했을 때 악성화율이 통계학적으로 의미 있게 낮았다(3.8% vs. 15.3%; p<0.0001). 따라서 이러한 특징을 갖는 고령이거나 기저질환이 많은 MD, Mixed-IPMN 환자의 경우 즉각적인 수술보다는 면밀한 추적 관찰을 고려해 볼 수 있을 것으로 판단된다.
결 론
췌장 IPMN의 추적 관찰 방법과 간격, 기간, 치료 등에 대하여 아직까지도 논란이 있다. 각각의 진료지침에 따라 수술이 필요한 경우와 관찰이 필요한 경우를 제시하고 있지만 추가적인 전향적 연구가 필요하다. WSF/HRS가 없는 BD-IPMN 경우 악성화 위험도가 낮으나 시간이 지나면서 췌장암의 발생이 높아지므로 오랜 기간 추적 관찰이 필요할 수 있다. HRS를 가진 IPMN은 악성종양을 동반할 가능성이 높아 수술적 치료가 필요하다. 그러나 WF만을 가진 경우는 각각의 인자마다 악성화 위험도가 다르고, HRS에 비하여 악성화 위험도가 낮다. 따라서 IPMN에서 포함된 WF 개수를 고려하여 치료 전략을 선택할 수 있다. 추적 관찰 중 새로운 WF 또는 HRS가 발생하면 악성화 위험성이 높으므로 환자의 전신적 상태를 고려하여 수술을 고려할 수 있다. 특히 고령이거나 기저질환이 있는 IPMN 환자의 경우 추적 관찰과 췌장 수술 관련 위험성과의 임상적 평가를 통해 치료 전략을 결정해야 한다.