췌장암과 감별이 어려웠던 황색 육아종성 췌장염 1예
요약
황색 육아종성 췌장염은 드문 사례로서 저자들은 췌장의 고형 종양이 의심되어 수술 후 조직검사로 진단된 황색 육아종성 췌장염(xanthogranulomatous pancreatitis)의 1예를 경험 했기에 문헌 고찰과 함께 보고한다.
Keywords: 황색육아종성췌장염, 종양, 염증
Abstract
Xanthogranulomatous inflammation (XGI) is characterized histologically by the deposition of foamy macrophages and infiltration of inflammatory cells. While XGI is extremely rare, it has been reported in the gallbladder, kidney, stomach, and lymph nodes. A 61-year-old woman presented with epigastric pain for 2 weeks. Abdominal computed tomography and magnetic resonance imaging showed a pancreatic head mass with distal common bile duct wall thickening. Endoscopic ultrasonography followed by fine needle aspiration was performed, and subsequent pathology report revealed a benign disease. Because uncontrolled abdominal pain persisted and possibility of malignancy could not be excluded, Whipple’s operation was eventually performed, and pathology report showed xanthogranulomatous pancreatitis (XGP). Herein, we report a case of symptomatic XGP mimicking of pancreas cancer. Although XGP is extremely rare, it should be considered as a differential diagnosis of neoplastic lesions of the pancreas.
Keywords: Xanthogranulomatous, Pancreatitis, Neoplasm, Inflammation
서 론
황색 육아종성 췌장염은 황색종 세포와 염증세포의 침윤 및 췌장 세포의 섬유화와 실질 손상이 동반되는 염증성 질환이다. 황색 육아종성 염증은 담낭, 신장, 피부, 임파선, 전립선, 자궁 내막 등 다양한 장기에서 나타날 수 있다[ 1- 2]. 황색 육아종성 췌장염은 매우 드문 질환으로, 초기 진단시 췌장 종양과 감별이 어렵다. 특히 방사선학적 검사를 통해서도 췌장암과 감별이 어렵고, 증상이 있는 경우는 내과적 치료로 완치를 기대하기 어렵기 때문에 수술적 치료가 필요한 경우가 많다[ 1, 3- 5]. 저자들은 췌장의 악성 종양과 감별이 어려웠던 황색 육아종성 췌장염 1예를 고찰과 함께 보고하는 바이다.
증 례
61세 여자가 내원 2주 전부터 심해진 심와부 통증으로 내원하였다. 환자는 내원 1주 전부터 소변이 진해지는 증상이 동반 되었다. 과거력상 7년 전 진단받은 고혈압과 고지혈증, 12년전 진단받은 당뇨로 치료받고 있었다. 음주력 및 흡연력은 없었다. 내원시 혈압은 100/57 mmHg, 맥박수 70회/분, 호흡수는 20회/분, 체온은 36.4°C였고, 급성 병색을 보였으나 의식은 명료하였다. 복부진찰에서 장음은 정상적이었고, 심와부의 압통은 있었으나 반발통은 없었으며, Murphy 징후 등의 소견은 없었다.
말초혈액검사에서 백혈구 13,230/µL, 혈색소 13.8 g/dL, 혈소판 500,200/µL로 나타났고, 아스파르테이트 아미노전이효소 21 IU/L (정상범위, 5-40 IU/L), 알라닌 아미노전이효소 26 IU/L (정상범위, 5-40 IU/L), 총 빌리루빈 0.8 mg/dL (정상범위, 0.2-1.4 mg/d), 알칼라인 포스파타아제 111 IU/L (정상범위, 40-129 IU/L), 아밀라아제 25 IU/L (정상범위 30-118 IU/L)로 정상 범위 이내였고, 감마 글루타밀전이효소 133 IU/L (정상범위, 8-69 IU/L), 리파아제 76 IU/L (정상범위 6-51 IU/L)로 상승소견을 보였다. 소변검사상 요당 4+ 이외의 소견은 없었다. 종양표지자검사에서는 CEA는 0.5 ng/mL 미만(정상범위 0-5 ng/mL)으로 정상이었으나 CA 19-9는 67.98 IU/mL (정상범위 0-37 IU/mL)로 상승소견을 보였다. 심전도, 단순 흉부 및 복부 촬영에서 특이소견은 관찰되지 않았다.
내원 후 시행한 복부전산화단층촬영( Fig. 1A) 및 췌장 자기공명영상( Fig. 1B)에서 췌장 두부와 구상돌기에 걸쳐 6 cm 가량의 일부 낭성 변화와 괴사가 동반된 종괴가 발견되었다. 종괴는 상장간동맥 및 정맥과 인접해 있었고, 췌관 확장 소견은 저명하지 않았으나, 총담관 말단 벽의 비후 소견 및 췌장 주변 병적 림프절 의심소견이 동반되어 췌장암 또는 유두상 점액 종양의 악성 변성을 의심할 수 있었다. F-18 FDG 양전자 컴퓨터단층촬영 소견상 췌두부 종괴와 췌장 주변 림프절에 걸쳐 과대사 소견이 관찰되었고( Fig. 1C), 췌장 내시경초음파상 췌두부에 불분명한 경계를 가진 혼합성 에코의 종괴 소견 관찰되어 25 gauge ProCore needle (Echotip, Cook ®, Bloomington, IN, USA)을 이용하여 췌장 두부의 불균일한 저에코성 종괴에 대해 세침흡인술을 시행하였다( Fig. 1D). 병리소견상 경증 이형성이 동반된 상피세포 소견이었다( Fig. 2). 환자 수액 조절 및 적절한 통증 조절을 포함한 내과적 치료에도 불구하고 지속적인 복통을 호소하였고, 영상 검사상 악성을 완전히 배제하기 어려웠기 때문에, 비록 세침흡인검사에서는 악성 세포가 관찰되지는 않았지만, 내원 9일째 췌십이지장절제술을 진행하였다. 수술시 종괴의 근위부 간동맥 침범 소견으로 간동맥 부분절제 및 총 간동맥과 문합술을 시행하였고 췌장 구상돌기와 상장간동맥 및 정맥과의 유착부위의 박리와 함께 췌장 두부, 소장, 담낭, 주변 림프절에 걸친 절제를 시행하였다.
절제된 췌장( Fig. 3A)은 황색의 경계가 불분명한 고형 종괴였으며, 병리 소견은 저배율 상( Fig. 3B)에서 엽상(lobulated) 종괴 및 주변 췌장 실질의 손상 소견, 고배율 상( Fig. 3C) 산재된 림프구를 동반한 포말성 대식세포의 침윤으로 황색 육아종성 염증에 합당한 소견이었다. 상기 환자는 수술 후 합병증이 나타나지 않았고 이에 경과 관찰 후 퇴원하였다. 이후 외래를 통해 보존적 치료를 유지하고 추적 관찰 중이다.
고 찰
황색 육아종성 염증은 포말상 조직구(lipid-laden histiocytes)를 가지는 황색종 세포와 염증 세포의 침윤이 동반되는 만성 혼합성 염증 과정의 드문 형태이다[ 1- 2, 5, 6]. 담낭, 신장, 전립선, 림프절 등에서 발생할 수 있으나 빈도가 높지 않고 췌장에 발생하는 경우는 매우 드물다[ 1, 5]. 그동안 보고된 증례들을 살펴보면 주로 남성에서 많이 발생했으며(남녀 비율, 1.83:1), 평균 연령은 57.3세였다(22-82세). 모든 환자는 수술적 치료 시행 후 조직학적으로 진단받았으며, 수술 전 진단은 관선 암종(ducatal adenocarcinoma)[ 7, 8], 관내 점액성 유두종양(intraductal papillary mucinous tumor)[ 4, 9], 관내 점액성 유두암(intraductal papillary mucinous carcinoma)[ 5, 10] 같은 종양, 가성낭종(pseudo cyst)[ 2, 11], 만성 췌장염[ 6] 등의 염증성 질환이었다( Table 1). 황색 육아종성 췌장염은 보고 자체가 드물고 국내에서는 단지 3번의 증례만 보고되었다[ 1, 4, 12]. 또한 이 질환은 수술 전 영상 소견만으로 종양 및 다른 염증성 질환을 감별하기 어렵기 때문에 주의 깊은 진단적 노력이 필요하다[ 1, 3, 4, 7, 9, 12, 13]. 본 환자는 내시경 초음파 유도하 세침흡인술 결과 상 악성 소견이 관찰되지 않았지만, 담관과 췌관의 협착으로 인한 지속적 통증이 있고, 종괴의 악성 변화 가능성을 배제할 수 없었기 때문에 수술을 진행하였다. 일반적으로 내시경 초음파 유도하 세침흡인술 검사는 췌장암 진단에 매우 유용한 검사이지만, 위음성이 존재하기 때문에 세침흡인술 결과만 가지고 종괴의 악성화 가능성을 완전히 배제할 수는 없었다. Woolf 등[ 14]에 따르면 췌장암에 있어 내시경 초음파 유도하 세침 흡인술 검사는 민감도(sensitivity) 77%, 특이도(specificity) 100%, 양성예측도(positive predictive value) 100%, 음성 예측도(negative predictive value) 54%, 정확도(accuracy) 82%이기 때문에, 췌장 악성 종괴에 대한 불완전한 진단 가능성을 고려하여 치료 계획을 수립하여야 한다. 황색 육아종성 염증은 병인이 명확하게 밝혀져 있지는 않다. 다만 농양, 괴사, 출혈 등이 원인으로 알려져 있고, 동반된 감염이나 결석 등으로 인한 담도 폐쇄 등이 발생에 관여한다[ 6]. 비교적 췌장의 황색육아종성 염증보다 빈도 높게 보고된 황색 육아종성 담낭염의 경우 담석으로 인한 로키탄스키-아쇼프 동(Rokitansky-Aschoff sinus)의 파열이나 점막 궤양을 통해 담즙이 담낭 벽으로 유입되고 염증 반응을 일으켜 불용성 지방이나 담즙을 포식한 조직구의 축적이 일어나 황색종 세포를 형성하는 것으로 추측하고 있다[ 15]. 또한 황색 육아종성 신우신염은 감염으로 인한 요도의 폐쇄가 육아종성 변화를 유발하는 것으로 보고 있다[ 1, 4]. 췌장에서의 육아종성 염증의 발병 기전 역시 명확히 밝혀지지 않았으나, 췌관 확장 혹은 가성 낭종이 동반된 경우, 낭성 종양이나 염증으로 인해 만들어진 낭성 병변에 출혈이나 감염이 동반되면서, 낭종 내부 압력 증가로 육아종성 변화를 일으킨 것으로 추정되고 있다[ 2]. Kamitani 등[ 9]은 췌장의 관내 점액성 유두 종양에 동반된 육아종성 염증의 증례에서 종양에서 분비된 점액(mucin)으로 인해 관내 압력이 상승되고, 점액 유출로 인해 발생할 것으로 추정했다. 또한 Iyer 등[ 7]은 증례를 통해 결석으로 인한 췌관 폐쇄와 속발된 세균성 감염으로 인해 이와 같은 염증이 발생한 것으로 보고했다. 황색 육아종성 췌장염의 치료 및 예후는 염증에 선행된 췌장질환에 따라 다르며, 내과적 치료에도 불구하고 조절되지 않는 증상과 농양과 같이 급성 염증이 심하게 동반되어있는 경우, 종양을 배제하기 어려운 경우 수술적 치료가 고려되어야 한다. 본 증례는 증상이 지속되며 췌장암을 배제하기 어려워 수술적 치료를 시행했고, 조직검사상 육아종성 췌장염으로 최종 진단되었다. 이전에 보고된 몇몇 증례와 마찬가지로 췌장의 종괴는 영상 소견만으로 악성 질환과 감별이 어려웠고, 본 증례의 경우는 내시경 초음파 유도하 세침 흡인술까지 시행하여 췌장암을 배제하였으나, 조절되지 않는 통증과 악성 변화의 가능성을 배제하지 못하여 근치적 수술을 진행 하였다. 아직까지 황색 육아종성 췌장염에 있어 영상학적 진단 기준이 명확하지 않고, 다른 염증성 질환 및 종양과의 감별이 어렵기 때문에 본 질환에 대한 주위 깊은 연구와 관찰이 필요하고, 치료 방법에 대한 추가적인 연구가 필요하다.
REFERENCES
1. Kim HS, Joo M, Chang SH, et al. Xanthogranulomatous pancreatitis presents as a solid tumor mass: a case report. J Korean Med 2011;26:583-586.  2. Ueno T, Hamanaka Y, Nishihara K, et al. Xanthogranulomatous change appearing in the pancreas cyst wall. Pancreas 1993;8:649-651.   3. Hanna T, Abdul-Rahman Z, Greenhalf W, Farooq A, Neoptolemos JP. Xanthogranulomatous pancreatitis associated with a mucinous cystic neoplam. Pathol Int 2015;66:174-176.  5. Nishimura M, Nishihira T, Hirose T, et al. Xanthogranulomatous pancreatitis mimicking a malignant cystic tumor of the pancreas: report of a case. Surg Today 2011;41:1310-1313.   6. Uguz A, Yakan S, Gurcu B, Yilmaz F, Ilter T, Coker A. Xanthogranulomatous pancreatitis treated by duodenum-preserving pancreatic head resection. Hepatobiliary Pancreat Dis Int 2010;9:216-218.  7. Iyer VK, Aggarwal S, Mathur M. Xanthogranulomatous pancreatitis: mass lesion of the pancreas simulating pancreatic carcinoma--a report of two cases. Indian J Pathol Microbiol 2004;47:36-38.  8. Shima Y, Saisaka Y, Furukita Y, et al. Resected xanthogranulomatous pancreatitis. J Hepatobiliary Pancreat Surg 2008;15:240-242.   9. Kamitani T, Nishimiya M, Takahashi N, Shida Y, Hasuo K, Koizuka H. Xanthogranulomatous pancreatitis associated with intraductal papillary mucinous tumor. AJR Am J Roentgenol 2005;185:704-707.   10. Iso Y, Tagaya N, Kita J, Sawada T, Kubota K. Xanthogranulomatous lesion of the pancreas mimicking pancreatic cancer. Med Sci Monit 2008;14:CS130-CS133.
11. Okabayashi T, Nishimori I, Kobayashi M, et al. Xanthogranulomatous pancreatic abscess secondary to acute pancreatitis: two case reports. Hepatogastroenterology 2007;54:1648-1651.  12. Kang BW, Kim JW, Jo JC, et al. A case of xanthogranulomatous pancreatitis. Korean J Med 2007;72:171-174.
13. Ikeura T, Takaoka M, Shimatani M, et al. Xanthogranulomatous inflammation of the peripancreatic region mimicking pancreatic cystic neoplasm. Intern Med 2009;48:1881-1884.   14. Woolf KM, Liang H, Sletten ZJ, Russell DK, Bonfiglio TA, Zhou Z. False-negative rate of endoscopic ultrasound-guided fine-needle aspiration for pancreatic solid and cystic lesions with matched surgical resections as the gold standard. Cancer Cytopathol 2013;121:449-458.   15. Houston JP, Collins MC, Cameron I, Reed MW, Parsons MA, Roberts KM. Xanthogranulomatous cholecystitis. Br J Surg 1994;81:1030-1032.  
Fig. 1.
(A) Abdominopelvic computed tomography revealed a solid and cystic mass involving head and uncinate process of pancreas and enhanced wall thickening in distal CBD. (B) Pancreatic magnetic resonance imaging presented solid mass including cystic or necortic portion in head and uncinate process of pancreas on T2-weighted image. (C) Positron emission tomography for a differential diagnosis demonstrated strong fluorodeoxyglucose uptake in mass of pancreatic uncinated process. (D) Endoscopic ultrasonography presented bizzare shape poorly defined pancreatic mass arising uncinate process. 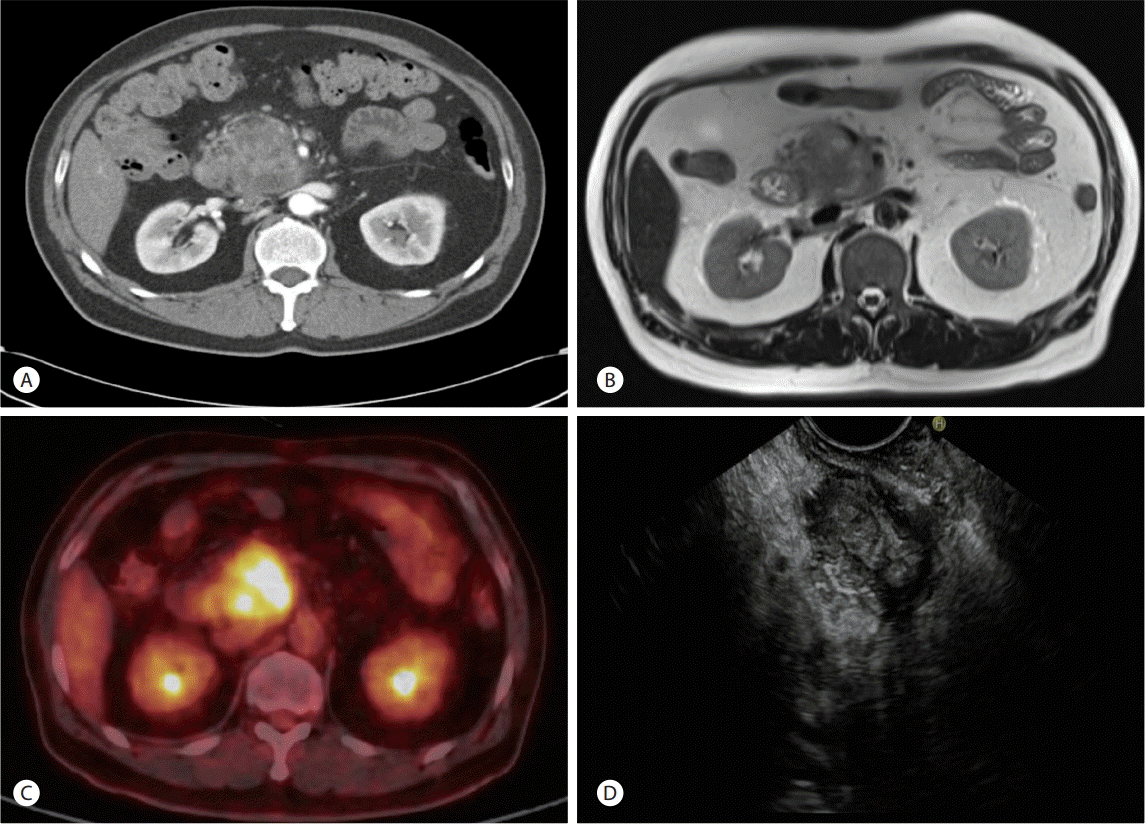
Fig. 2.
Pathologic findings of specimen of distal common bile duct : Fragments of bland-looking epithelial cells. Foamy macrophages (green arrows) with lymphocytes and neutrophils (H&E, ×400) 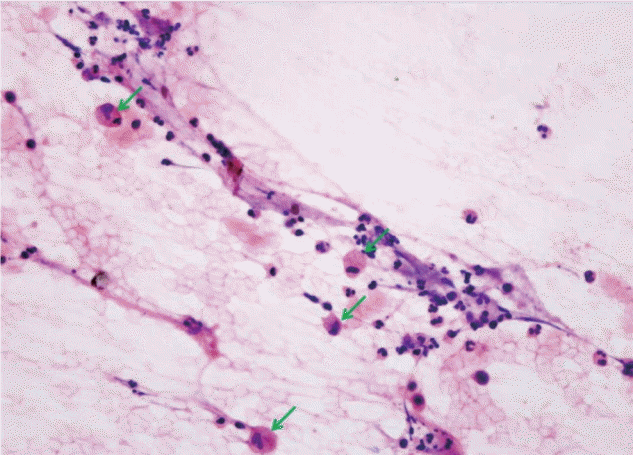
Fig. 3.
Pathologic findings of the xanthogranulomatous pancreatitis. (A) Resected specimen shows a yellowish solid mass with ill defined margin (white arrows). (B) The low power view of the lesion. The lesion showed lobulation and destruction of adjacent pancreatic parenchyme (yellow arrows) (H&E, ×12.5). (C) The high power view of the lesion. The lesion was composed foamy macrophages and scattered lymphocytes (H&E, ×400). 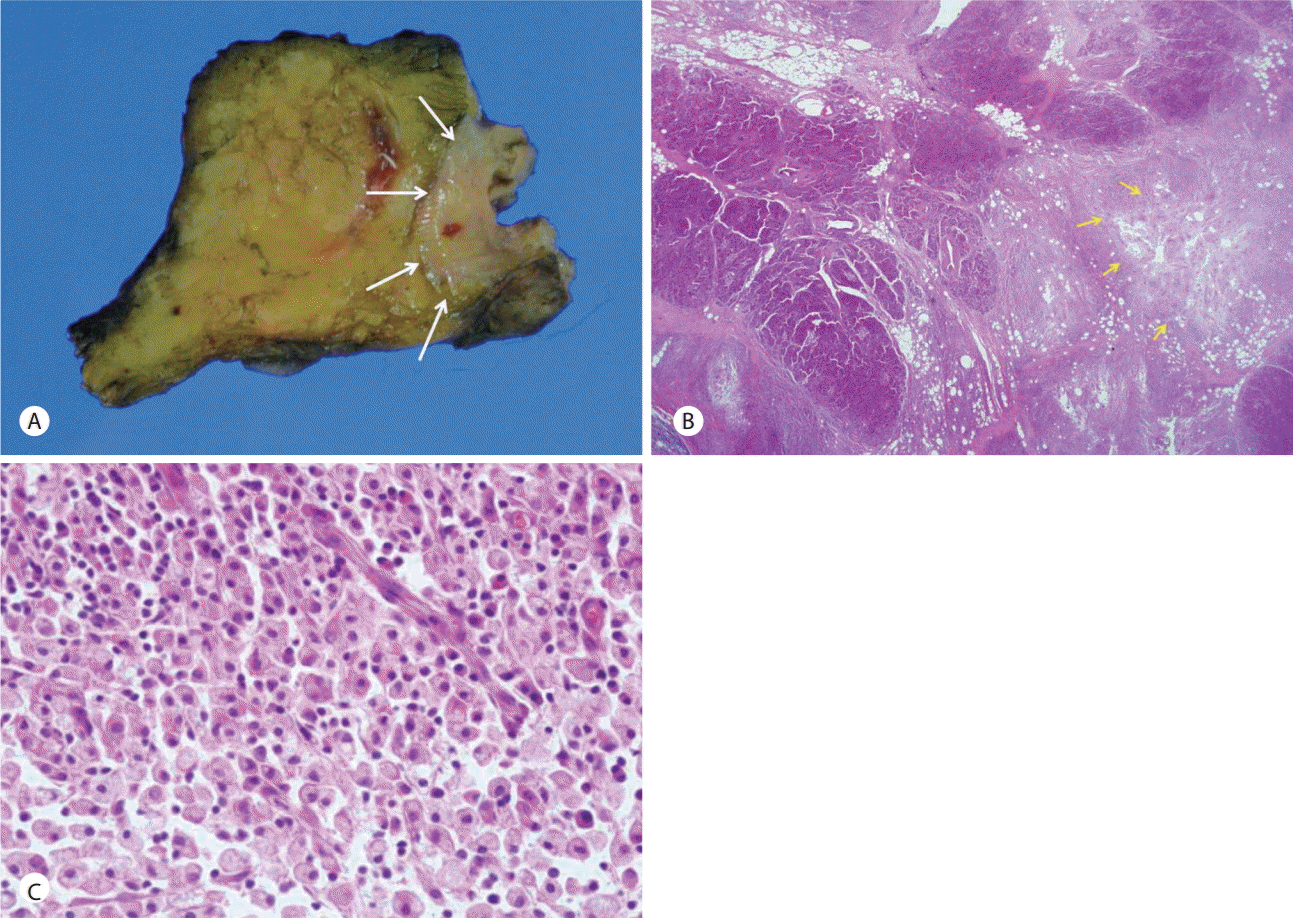
Table 1.
Clinicopathologic features of previously reported xanthogranulomatous pancreatitis
|
Pre-op diagnosis |
Author |
Year |
Sex/Age |
Symptoms |
Site |
Size |
EUS-FNA (Y/N) |
Operation |
Combined pancreatic disease |
|
Chronic pancreatitis |
Kang BW et al. [12] |
2007 |
F/22 |
Abdominal pain |
Head |
N/A |
N |
PPPD (First Korean Case) |
None |
|
Uguz A et al. [6] |
2010 |
F/34 |
Abdominal pain |
Head |
N/A |
N |
PPPD |
None |
|
Uguz A et al. [6] |
2010 |
M/30 |
Abdominal pain |
Head |
N/A |
N |
PPPD |
None |
|
Pseudocyst |
Ueno T et al. [2] |
1993 |
M/42 |
Abdominal pain |
Body |
N/A |
N |
Distal Pancreatectomy |
Pancreatic pseudocyst |
|
Okabayshi T et al. [11] |
2007 |
M/60 |
Abdominal pain |
Tail |
N/A |
N |
Distal Pancreatectomy |
Pancreatic pseudocyst |
|
Okabayshi T et al. [11] |
2007 |
M/69 |
Abdominal pain |
Tail |
N/A |
N |
Distal Pancreatectomy |
Pancreatic pseudocyst |
|
IPMT |
Kamitani T et al. [9] |
2005 |
M/82 |
Epigastric pain |
Body |
3 cm |
N |
Whipple’s operation |
IPMT |
|
Kim YN et al. [4] |
2010 |
F/72 |
Incidental mass |
Body |
N/A |
N |
PPPD |
IPMC |
|
SPPT |
Ikeura T et al. [13] |
2009 |
M/73 |
Incidental mass |
Body |
3.2x2.7 cm |
N |
PPPD |
None |
|
IPMC |
Iso Y et al. [10] |
2008 |
M/82 |
weight loss |
Tail |
2.2x1.1 cm |
N |
Distal Pancreatectomy |
IPMT (Head) |
|
Nishimura M et al. [5] |
2011 |
M/76 |
weight loss |
Body |
5.2x2.6 cm |
N |
Distal Pancreatectomy |
None |
|
Pancreatic cancer |
Iyer VK et al. [7] |
2004 |
M/36 |
Abdominal pain |
Tail |
N/A |
N |
Mass excision |
None |
|
Iyer VK et al. [7] |
2004 |
M/50 |
Jaundice |
Head |
N/A |
N |
Whipple’s operation |
None |
|
Shima Y et al. [8] |
2008 |
M/66 |
Epigastric pain |
Body |
4 cm |
N |
Distal Pancreatectomy |
None |
|
Kim HS et al. [1] |
2010 |
F/72 |
Abdominal pain |
Head |
2.2x2.0 cm |
N |
Whipple’s operation |
None |
|
Hanna T et al. [3] |
2015 |
F/50 |
Epigastric pain |
Body |
14.0x14.0 cm |
N |
Radical Pancreatectomy |
Mucinous cystic neoplasm |
|
Present case |
2016 |
F/61 |
Epigastric pain |
Head |
6.2x6.0 cm |
Y |
Whipple’s operation |
None |
|
|















