서 론
췌장은 다양한 낭성 변화를 동반하는데 최근에서 영상 기술이 발전하면서 췌장의 낭성 병변이 더욱 자주 관찰된다[1]. 췌장의 낭종은 비종양성 낭포와 종양성 낭종으로 나눌 수 있다. 비종양성 낭포는 가낭포(pseudocyst)와 염증과 연관하여 발생하는 낭포 등을 말한다. 종양성 낭종은 다양한 세포 기원의 종양에서 낭성 변화를 보이는 것을 의미하는 것으로, 전체 낭성 병변의 60% 정도를 차지한다.1 종양성 낭성 병변의 대부분은 관 구조 기원의 종양으로 종양 세포의 특징에 따라 점액성 또는 장액성 낭성 종양 등으로 나눈다. 췌장의 점액성 종양성 낭종 중 관내 유두상 점액성 종양(Intraductal Papillary Mucinous Neoplasm, IPMN)은 모든 절제된 췌장의 20-30%에 달하는 종양으로 최근에 발생 빈도가 더욱 증가하고 있다[2]. 이에 IPMN의 특징을 병리학적 관점에서 살펴보고자 한다.
본 론
1. IPMN의 특징
췌장에서 발생하는 이질적인 낭성 병변은 1990년대에 처음 보고되었고, IPMN이라는 용어는 World Health Organization(WHO)의 2000년 분류에서 정립되었다[3]. IPMN은 병리학적으로 일반적으로 유두를 형성하고 췌관의 낭포성 확장과 임상 및 육안으로 감지할 수 있는 종괴를 형성하는 종양성 점액 세포의 관내 증식을 특징으로 한다(Fig. 1). 진단 시 평균 연령은 68세로 여성보다 남성에서 약간 더 자주 관찰되며 주로 췌장의 두부에서 발생한다[1,4]. 두꺼운 점액이 생성되는 것이 특징이며 주췌관과 분지관의 확장과 점액 분비 췌관 상피의 관내 증식 그리고 주변 췌장의 위축을 동반한다. 2012년과 2017년의 Fukuoka 지침에 따르면 췌관 폐쇄의 뚜렷한 원인없이 직경 5 mm 이상의 가시적인 주췌관 확장 병변을 가지는 종양을 이르며 이는 췌관과 연결되어 있다[5,6].
반면에 점액성 낭성 종양(Mucinous Cystic Neoplasm, MCN)은 IPMN과 마찬가지로 췌장에서 점액을 분비하는 종양의 하나로 진단 시 평균 연령은 48세로 95% 이상 폐경기 전후의 여성에서 발생하며, 종양의 95% 정도가 췌장의 체부와 미부에서 발견된다[4,6,7]. 육안상으로 췌관과는 연결이 없고 특히 조직학적으로 점막 상피 주위에 난소 기질을 가지는 특징이 있다. IPMN과 MCN은 췌장암종의 전구 병변으로 알려져 있다[8,9].
낭포액에서 암배아항원(Carcinoembryonic Antigen, CEA)을 분석하면 점액성 췌장 낭성 종양에서 비점액성 종양에 비해 특이하게 증가한다[10]. 따라서 IPMN과 MCN에서 점액성 낭포액을 분석하면 두 종양 모두에서 동일하게 CEA 증가와 RNF43 돌연변이를 관찰할 수 있다[6,11]. KRAS 유전자의 코돈 12의 점 돌연변이는 췌장의 선암종(67%)에서 다수 관찰되었으나 IPMN이나 만성 췌장염에서도 관찰되어 이것으로 암종과 선종의 감별은 어렵다[12]. 최근에 IPMN의 41-75%에서 코돈 201에서 활성화된 GNAS 돌연변이를 발견하여 이는 IPMN 진단에 매우 특이적인 유전적 변형으로 알려져 있다[12].
2. IPMN의 분류와 진단
비침습적 IPMN은 조직학적 특징에 따라 저등급 이형성(low grade dysplasia)과 고등급 이형성(high grade dysplasia)으로 나눈다(Fig. 1) [8]. 조직학적으로 유사분열이나 괴사없이 방향이 좋고 작고 균일한 핵을 가진 단일 층의 종양 세포를 갖는 것은 저등급 이형성 IPMN으로 분류한다. 핵 다향성을 동반하고 여러 층으로 중첩되거나 채모양으로 붙어있는 등 심각한 행의 극성 상실과 유사분열이 종종 관찰되는 병변은 고등급 이형성 IPMN으로 분류한다.
IPMN은 조직학적 형태에 따라 4가지 조직학적 아형(위, 장, 췌담도 및 호산성)으로 분류한다(Fig. 2) [13]. IPMN은 위 아형이 제일 많고, 면역조직화학염색에서 MUC5AC와 MUC6에 양성을 나타낸다. IPMN의 장 아형은 MUC2와 MUC5AC에 양성, 췌담도 아형은 MUC1과 MUC5AC에 양성, 그리고 호산성 아형은 MUC1과 MUC6에 양성으로 구별할 수 있다 [14]. IPMN의 장, 췌담도 및 호산성 아형은 주로 주췌관에서 발생하지만 위 아형은 일반적으로 분지관에서 발생한다[8,13,14].
IPMN은 종양 침범 위치에 따라 주췌관형(Main Duct IPMN, MD-IPMN)과 분지관형(Branch Duct IPMN, BD-IPMN), 그리고 혼합형(mixed type)으로 분류한다[6]. MD-IPMN은 전체 IPMN 중 24.7% 정도로 췌장의 주췌관 확장 소견을 보이고 종양 주위에 만성 췌장염을 동반한다[5]. MD-IPMN은 약 62.2% 정도에서 침윤성 암종으로 이행한다[4,5,15]. 반면, BD-IPMN은 56.8% 정도의 빈도로 분지관에 국한되어 발생하고 비교적 젊은 연령에서 발생하며, 약 10-22% 정도 침윤성 암종으로 이행한다[4,5,16]. 주췌관형과 분지관형을 모두 가지고 있는 혼합형의 경우는 17.6% 정도 빈도로 발생하며 57.6% 정도에서 침윤성 암종으로 이행한다(Fig. 1) [5]. IPMN이 침습적이 되면 일반적으로 관형 및 콜로이드 암종이라는 두 가지 다른 유형의 침습성 암종이 발생한다(Fig. 1) [13,17].
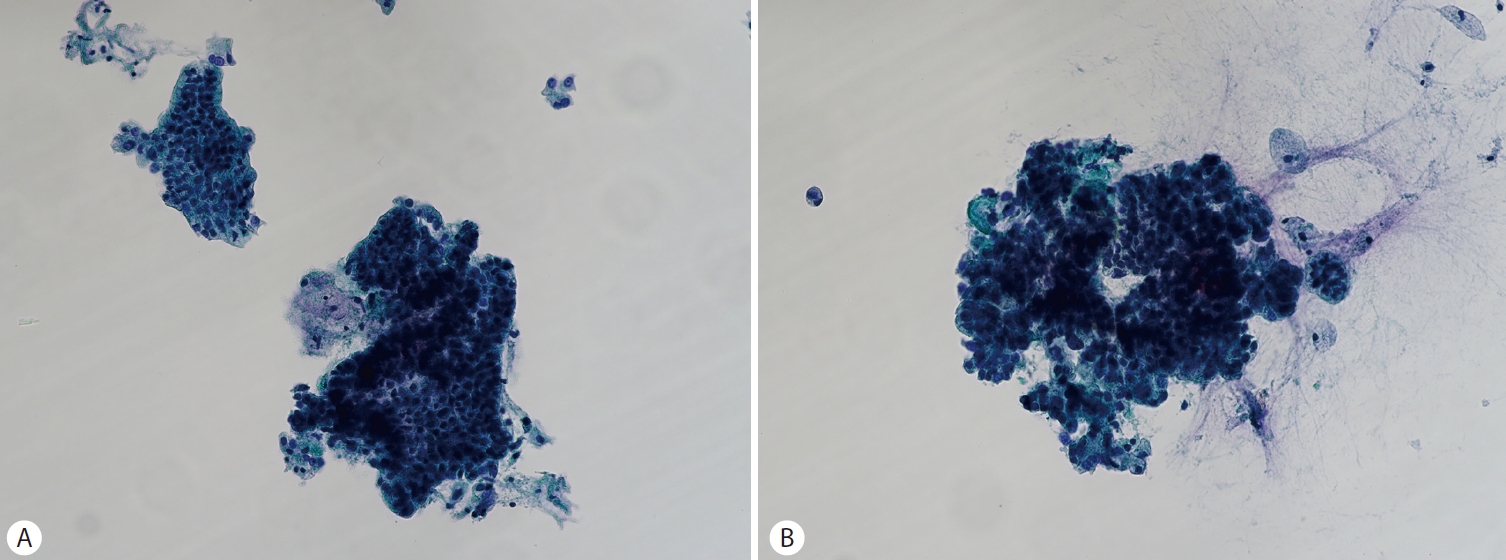
내시경초음파 세포검사로 IPMN을 진단할 수 있는데 이 때 점액의 배경에 다양한 이형성 정도의 점액 상피의 유두 조각을 관찰할 수 있다(Fig. 3). IPMN은 핵 이형성, 현저한 핵소체, 핵 불규칙성 및 세포 밀집으로 나타나는 고등급 이형성에 대해 잘 평가해야 한다[1].
내시경초음파 세포검사로 얻은 낭포 내용물의 세포뿐만 아니라 암배아항원(>200 ng/mL) 분석은 점액성 췌장 낭성 병변을 구별하는데 쓰이고 아밀라아제(<250 IU/L) 분석은 가성낭종을 배제하는데 종종 유용하다[10,18]. 그러나 이들 내시경초음파 세포검사로 얻은 낭포 내용물의 세포학이나 암배아항원, 아밀라아제 화학적 분석으로는 MCN과 IPMN을 구별할 수 없다[10]. 따라서 임상 병력, 성별, 영상 특성, 세포학, 낭포액, 암배아 항원 및 아밀라아제의 화학적 분석 그리고 KRAS나 GNAS 등 분자검사들을 조합하여 비로소 췌장의 낭종을 점액성 또는 비점액성으로 특징지을 수 있을 뿐만 아니라 특정 하위 유형을 보다 정확하게 감별할 수 있다[1,12,19-21].
3. 관내 유두상 점액성 종양의 치료와 예후
2017년 IPMN 관리 지침에 따르면 '고위험군(high-risk stigmata)’ (췌두부 낭성변화를 가진 환자의 폐쇄성 황달, 조영 증강된 5 mm 이상의 결절, 10 mm 이상의 주췌관 크기)이 있는 환자는 절제술을 받아야 한다고 권장한다[6]. 또 ‘우려되는 특징(worrisome features)’ (3 cm 이상 크기의 낭종, 조영 증강된 5 mm 미만의 결절, 두껍게 조영 증강된 낭종 벽, 5-9 mm의 주췌관 크기, 말단 췌장 위축을 동반한 주췌관 구경의 급격한 변화, 림프절병증, CA19-9 혈청 수치 상승 및 2년에 5 mm 이상의 빠른 낭종 성장)은 내시경 초음파에 의해 평가되어야 한다[6].
종양의 위치와 세포 형태에 따라 대부분의 MD-IPMN 환자는 종양 절제술을 받아야 한다[22]. 절제술을 받지 않은 BD-IPMN 환자는 악성 변화의 조기 발견과 별도의 췌장암을 위해 내시경 초음파를 포함한 세심한 감시를 받아야 한다[23]. 고등급 이형성 또는 침윤성 암종을 동반하였거나 장 또는 췌담도 아형의 IPMN 환자는 초기 절제 후 잔여 췌장에 대한 면밀하고 장기적인 감시를 받아야 한다. IPMN은 췌장 선암종에 비해 양호한 예후를 나타내지만, IPMN에 대한 부분 췌장 절제술 후, 잔존 췌장에서 고위험 병변의 이차적 발생 위험에 대한 평가는 수술 후 감시 방식 및 추적 기간을 확립하는 데 중요하다[24].
결 론
췌장 낭성 종양 중 IPMN과 MCN은 췌장 선암종의 전구 병변이다[4,8]. 따라서 육안적으로 종양의 위치와 크기 기술을 정확하게 하고 조직학적으로 이형성 정도에 따라 저등급, 고등급으로 분류하고, 침윤성 선암종의 존재 여부를 세심하게 잘 살펴 진단하는 것이 중요하다. 또한, 내시경초음파 세포 검사로 얻어진 세포 검체를 세포학적 특징에 따라 정확하게 진단하거나 분자병리학적 분석을 통해 유전자 변이 유무를 파악하는 것이 진단에 도움이 될 것이다[2]. 그 외에도 관내 상피의 아형 분류나 면역조직화학 검사 및 림프절 전이 유무 기술 등으로 예후 예측에 도움이 될 수 있다.