유두부 종양의 진단과 치료에서 내시경의 역할
Abstract
Tumors of the major duodenal papilla, also known as ampullary tumor, are rare with an approximate 5% incidence of all gastrointestinal neoplasm. These tumors seem to be detected more frequently with increasing performance of upper endoscopic examination and endoscopic retrograde cholangiopancreatography (ERCP). Adenoma, most common benign disease of ampullary tumor, is very important because of its potential to undergo malignant transformation to ampullary cancer. Especially, endoscopic ultrasound or transpapillary intraductal ultrasonography can provide more detailed and accurate information on the extent of ampullary tumors and proper treatment should be done after diagnosis. Considering perioperative morbidity and mortality of surgical resection, endoscopic papillectomy is regarded as a curative treatment of ampullary adenoma. However, the indication of the procedure is very strict and there are various complications related to the procedure. Therefore, it is important to understand the role of endoscopy in diagnosis and treatment of ampullary tumor. In this review, the diagnostic role of endoscopy for ampullary tumor and the treatment method of endoscopic papillectomy will be discussed.
Keywords: Ampullary tumor, Ampullary adenoma, Ampullary cancer, Endoscopic papillectomy
Keywords: 십이지장 유두부 종양, 십이지장 유두부 선종, 십이지장 유두부 선암, 내시경 유두 절제술
서 론
십이지장 팽대부(ampulla of Vater) 또는 십이지장 유두부는 총담관과 주췌관 말단부가 합류하면서 형성되는 구조로 십이지장의 후내측 유두 모양의 구조이다[ 1, 2]. 십이지장 유두부 종양은 모든 소화기 종양의 약 5% 빈도로 보고되고 있으며, 부검 결과에 따르면, 일반인의 0.21-0.35%에서 발견된다[ 3- 5]. 최근 위장관 질환의 조기 진단을 위한 상부위장관 내시경 검사, 내시경적 역행성 담췌관 조영술과, 복부 초음파, 컴퓨터 전산화 단층 촬영 등 진단 기술의 발전으로 인해 유두부 종양의 발견 빈도는 증가하고 있으며, 이에 따른 다양한 수술 및 내시경적 치료 방법이 시도되고 있다. 이에 본 고에서는 점차 증가하고 있는 십이지장 유두부 종양, 특히 십이지장 유두부 선종 및 선암의 진단과 치료에 있어 내시경의 역할에 대해 알아보자 한다.
십이지장 유두부 종양의 분류
십이지장 유두부 종양은 병리 소견에 따라 선종(adenoma), 선암(adenocarcinoma), 림프종(lymphoma), 내분비신경세포종(neuroendocrine tumor), 지방종(lipoma), 섬유종(fibroma), 과오종(harmatoma) 등으로 분류된다. 대부분의 종양은 상피세포 기원의 선종(adenoma), 또는 선암(adenocarcinoma)이며, 선종은 조직학적으로 관상융모 선종(tubulovillous adenoma), 융모 선종(villous adenoma), 관성 선종(tubular adenoma)으로 분류된다. 이 중 융모상 선종과 관상 융모상 선종이 가장 흔하게 발견되며 융모상 선종은 악성화의 가능성이 가장 높다[ 6- 8]. 내시경적 절제술의 주요 적응증인 선종은 산발적(sporadic) 또는 가족성 선종성 용종증(Familial adenomatous polyposis, FAP) 환자에서 결장 외 발현의 하나로 발생한다[ 9- 12]. 산발적 선종은 일반인의 0.1%에서 발생하며, 가족성 선종성 용종증 환자의 경우 50-100%에서 유두부 선종이 발생한다[ 4]. 십이지장 유두부 선종은 바터 팽대부선암 병변 주변에서 선종이 흔히 발견된다는 점과, 선종으로 절제된 조직의 약 30%에서는 국소적인 선암 병변이 함께 관찰된다는 증거를 통해, 대장암과 유사하게 다단계 암 발생 과정을 보이는 전암 병변으로 간주되며, 암발생 방지를 위한 적극적인 절제술이 필요하다[ 4, 11- 14].
십이지장 유두부 종양의 내시경을 이용한 진단
컴퓨터 전산화 단층 촬영, 자기 공명 영상, 양전자 단층 촬영은 유두부 종양을 진단하는데 일차적 진단 도구로서 민감도가 낮아 내시경과 내시경 초음파가 진단의 기본 도구로 사용된다. 특히 최근에는 상부위장관 내시경 검사가 널리 사용됨에 따라 직시경 검사를 통한 십이지장 유두부 종양의 발견이 보다 빈번하게 이루어지고 있다. 그러나 직시경 검사를 통해 십이지장 유두부를 완벽하게 관찰하는 것이 언제나 가능한 것은 아니기 때문에 기본적으로 유두부 종양의 관찰을 위해서는 측시경을 이용한 육안 검사와 췌관과 담관 영상 획득을 위한 내시경적 역행성 담췌관 조영술이 필요하다[ 15]. 즉, 내시경을 이용한 십이지장 유두부 종양의 검사는 종양의 크기, 주변 점막의 육안적 변화 유무의 확인 및 조직 생검을 위한 측시경 검사( Fig. 1)와 함께 담관 또는 췌관내 종양의 침범 유무를 확인하기 위한 내시경적 역행성 담췌관 조영술 검사가 필수적이다.
1. 내시경 육안 소견과 조직 생검
십이지장 유두부 선종을 포함한 양성 병변은 종양 점막의 미란 또는 궤양이 없고 자발 출혈이 관찰되지 않는 비교적 경계가 분명한 소엽성(lobular) 또는 솔방울(pine-cone) 모양의 종괴로 관찰된다[ 16]. 그러나 내시경을 통한 육안적 소견만으로는 십이지장 유두부 선종과 선암의 감별 진단은 불가능하다. 또한 일부 십이지장 유두부 선종은 십이지장 유두내강으로 종괴를 형성하여 십이지장 유두부 표면은 종괴로 인한 크기의 변화 외에 특징적인 점막 표면의 변화가 없는 경우도 흔하기 때문에 측시경을 통한 육안적 관찰만으로는 진단이 불가능한 경우도 있다. 따라서 측시경을 통한 육안 검사와 함께 종양 병변에 대한 조직 생검이 반드시 필요하다. 십이지장 유두부 선종에 대한 조직생검을 통한 진단은 비교적 쉽게 이루어진다. 그러나 선종성 병변의 약 30%에서 선암 병변이 동반될 수 있음을 감안하면, 다중 생검을 통해 최소 6개 이상의 생검 조직을 획득하는 것은 매우 중요하다[ 17].
2. 내시경초음파 및 관강내 세경 초음파
내시경 초음파는 십이지장 유두부 종양의 평가에 매우 유용한 검사법이다. 특히 종양의 범위와 팽대부 주위 점막층, 총담관, 및 췌관의 침범을 확인하는 데 유용하다[ 18]. 현재까지의 연구들은 십이지장 유두부 종양의 T병기 진단에 약 60-80%의 정확도를 보여 CT, MRI에 비해 보다 뛰어난 것으로 보고하고 있다[ 19, 20]. 한편 IDUS는 십이지장경의 겸자공을 통하여 총담관 또는 주췌관 내로 직접 삽입하여 검사를 시행하며, 상대적으로 높은 주파수(20-30 MHz)를 사용함으로써 십이지장 유두부와 담관 및 췌관의 해부학적 구조에 대한 보다 세밀한 영상을 획득할 수 있다. 현재까지 십이지장 유두 부 종양의 진단에 있어 내시경 초음파 검사와 관강내 세경 초음파 검사를 비교분석한 연구들에 따르면 관강내 세경 초음파 검사가 T stage를 확인하는 데 내시경초음파 검사에 비해 높은 정확성을 보였다[ 21- 23]. 그러나 내시경 초음파 검사와 관강내 세경 초음파 검사는 모두 십이지장 유두부 종양의 침범 범위를 확인하는 데 가장 유용한 검사들이다( Fig. 2). 즉, 이 검사를 이용한 정확한 병기 설정은 십이지장 유두부 종양에 대한 최적의 치료법을 결정하는 데 가장 중요한 단계임을 숙지하여야 하겠다.
3. 내시경적 역행성 담췌관 조영술
종양이 담관 또는 췌관을 침범한 경우 내시경 유두 절제술을 통한 종양의 완전 절제 가능성은 낮아진다. 그러므로 내시경 역행 췌담관 조영술은 치료 전 병기를 확인하는 데 중요하다. 특히 내시경 유두 절제술을 시행할 경우에는 반드시 내시경적 역행성 담췌관 조영술을 시행하여 담관과 췌관내 종양의 침범을 평가하여야 한다. 또한 내시경적 십이지장 유두 절제술 후에는 췌장염의 발생 위험을 낮추기 위해 예방적으로 시행하는 췌관내 플라스틱 도관 삽입을 위해서도 필요하다.
십이지장 유두부 종양의 내시경 치료
1. 내시경 치료의 적응증
내시경 유두 절제술은 1983년 Suzuki에 의해 처음 시행되었고 그 후로 많은 연구들에서 내시경적 치료의 안전성을 입증하였다[ 24- 26]. 내시경 절제술은 기존의 수술과 다르게 전신마취와 개복이 필요하지 않아, 적응증이 확대되고 있으며, Cheng 등[ 27]은 다기관 연구 결과를 통해 내시경 유두절제술을 유두 선종의 일차적 치료법으로 제안하기도 하였다. 현재 널리 인정되는 내시경 유두 절제술의 적응증은 담관과 췌관을 침범하지 않은 유두부 선종이다. 보다 구체적인 적응증을 살펴보면 1) 종괴의 크기가 4-4.5 cm 미만이거나 십이지장 원주의 반 이하, 2) 내시경 소견에서 악성의 소견-불규칙한 경계, 궤양, 함몰, 자연 출혈 등이 없고 종괴가 단단하지 않을 것, 3) 최소 6개 이상의 조직 검사에서 양성 선종일 것 4) 내시경 초음파 또는 관강내 세경 초음파(IDUS)에서 담관과 주췌관의 침범이 없어야 한다[ 16, 24, 26, 28]. 일반적으로 고도 이형성증은 양성 선종에 포함되므로 내시경 절제술에 해당한다. 또한 내시경 유두 절제술을 시행 후 확인된 고분화 점막내암의 경우는 절제연이 정상이고, 혈관 및 임파선의 침범이 없는 경우 추가적인 수술이 필요하지 않을 수도 있다. 그러나 이 경우는 앞으로 보다 많은 환자를 대상으로 하는 전향적 연구가 필요하다.
2. 내시경 유두 절제술 술기
일반적으로 내시경 유두절제술은 측시경의 겸자공을 통해 올가미로 병변을 포획함으로써 절제술을 시행한다( Fig. 3). 시술 전에 병변의 모양을 세밀히 관찰함으로써 모양, 크기, 변연 및 궤양 유무를 파악하고, 유두 절제술이 가능하다고 판단되면 겸자공을 통하여 절제술용 올가미를 넣어 병변을 에워싼 다음 서서히 조여 병변을 포획한다. 우선적으로 일괄 절제를 시도하지만 여의치 않은 경우에는 분할 절제를 시행할 수도 있다.
점막하 주사(submucosal injection)
내시경 유두절제술 시의 점막하 주사는 위나 대장의 종양성 병변에 대한 내시경적 절제술에 사용되는 생리식염수, 에피네프린 희석 용액(1:10,000-20,000) 등을 점막하층에 주입하여 병변의 거상을 위해 사용된다. 그러나 내시경 유두 절제술에 있어 생리 식염수 또는 희석된 에피네프린을 점막하층에 주입하는 것의 역할에 대해서는 논란의 여지가 있다[ 27]. 점막하층 주사를 선호하는 그룹은 식염수 주입으로 천공을 예방하는 데 도움이 되고, 절제술 후 출혈의 위험성을 낮출 수 있으며, 주입시 거상이 되지 않는 병변은 깊게 침윤된 종양임을 알 수 있어 시술의 적응증이 되지 않는 종양을 선별하는 데 도움이 된다고 주장한다[ 24, 29]. 이에 반해, 식염수 주입을 반대하는 그룹은 식염수 주입 없이도 별다른 어려움 없이 절제가 가능하고, 주입된 식염수에 의해 병변의 범위가 모호해지거나 종양의 크기가 작은 경우는 종양과 함께 주위 조직이 같이 융기되어 올가미로 포획하는 데 오히려 방해를 주는 경우도 있다고 주장한다[ 28, 30]. 따라서 유두 절제술 전 점막하 주사는 일괄적으로 추천되는 것은 아니다.
올가미를 이용한 종양 포획 및 절제(snaring and endoscopic resection)
내시경 유두 절제술에서 어떤 유형의 snare를 사용하는지에 대한 정해진 기준은 없다. 사용하는 올가미는 종괴의 크기에 따라 결정되며 형태는 원형 또는 난원형의 용종 절제용 올가미를 사용한다. 가능하면 일괄 절제를 하도록 한 번에 정상 점막을 일부 포함하여 유두부 전체를 잡도록 시도하는 것이 중요하다. 병변을 두측 또는 미측 어느 방향에서 올가미를 걸어 포획하는 문제는 시술의 편의성에 따라 결정되지만, 대개 두측에서 시작하여 항문쪽으로 잡는 것이 더 용이하다. 올가미를 통한 병변의 포획을 확인한 뒤에는 전기 소작법을 이용하여 종양을 절제하는데, 이때 사용되는 전기 소작 고주파 전류는 순수절개파, 혹은 혼합파가 모두 사용 가능하며, 효과적인 파형과 구체적인 출력에 대한 통일된 의견이 없다. 일부 연구자들은 응고파에 의한 부종을 막기 위해 순수 절개파의 사용을 추천하기도 하나[ 16, 30, 31], 출력 장치 제조사 각각의 추천 전류가 다양하여 술자의 선호도로 인해 결정된다.
절제된 종양 조직 회수 및 절제술 후 처지(tissue retrieval and postprocedure management)
유두 선종 내에 국소적으로 선암 병변이 존재할 가능성이 있으므로 절제된 조직의 회수는 매우 중요하다. 절제된 조직에 대해서는 크기, 형태, 조직학적 소견, 현미경상 침윤 깊이, 췌담관 내 침범여부, 변연부 상태 등에 대한 병리학적 검토가 반드시 이루어져야 한다. 조직 회수 후 절제 부위에 대한 육안 검사를 통해 출혈의 유무를 확인하여야 하고, 잔류 종양의 유무에 대한 확인이 필요하다. 특히 종양을 절제한 후에 완전 절제가 되지 않고 병변이 남아있는 것이 의심되는 경우에는 추가의 시술을 통하여 잔류 종양의 완전한 제거를 시도한다. 생검 겸자 또는 올가미를 통해 다시 남아있는 조직의 절제를 시도하여야 하며, 유효성이 입증되지는 않았지만 소작술을 추가적으로 시행하기도 한다. 특히 크기가 큰 병변에 대하여 분할절제를 시행한 경우에는 재발 가능성이 높다고 추론할 수 있으므로 추가적인 소작술을 시행하는 이론적 근거가 있으며, 이는 지혈의 효과도 기대할 수 있다. 소작술 방법은 단극성, 양극성 전기 소작, Nd-YAG 레이저 소작, 아르곤플라즈마응고소작 등이 있다[ 32]. 열소작 방법의 효용성에 대한 후향적 연구에서 종양의 제거 성공률은 열소작을 추가로 시행한 군과 시행하지 않은 군 간에 차이가 없었으며[ 33], 각각의 열 소작 방법을 비교한 무작위 대조군 연구는 아직 없어, 현재 잔류 종양의 제거 방법은 내시경 술자의 선호도에 따라 결정된다.
췌관 스텐트 및 담관 스텐트 삽입(pancreatic and/or biliary stent placement)
내시경 유두 절제술후 췌관내 스텐트 삽입은 현재까지 소규모의 전향적 연구와 일부 후향적 분석을 통해 시술 후 발생하는 췌장염의 예방에 효과가 있는 것으로 보고되었다[ 26, 27, 33]. 즉, 절제술 후 췌관 스텐트의 삽관은 시술 후 췌관 개구부의 염증성 부종으로 인한 췌관 페쇄를 막아 치명적인 췌장염을 예방하고, 췌관 개구부의 협착 위험성을 최소화할 수 있으며, 다른 추가적인 열 소작 등의 안전한 시술을 가능하게 한다. 현재까지 췌관스텐트 사용에 대한 대규모 전향적 연구는 없으나, Harewood 등[ 34]은 소규모 전향적 연구를 통해 스텐트 삽관의 필요성을 주장하였다. 또한 유두 절제술 후의 췌장염은 췌관 스텐트를 넣지 않는 경우 더 흔하므로, 시술 후 가능하면 췌관내 스텐트를 삽입하는 것이 추천되지만, 시술 직후 췌관내 선택적 삽관이 어려운 경우는 일단 시술을 종료하고 경과를 관찰하는 것도 대안이 될 수 있다. 췌관 스텐트와 달리 담관염의 위험을 줄이기 위한 담관 스텐트 삽입은 모든 환자에서 권고되지는 않으며, 유두절제술 후 담관 개구부가 명확하게 확인되지 않거나 담관의 배액이되지 않는 경우에 담관 괄약근 절개술 및 담관 스텐트의 삽입을 고려할 수 있다[ 16, 24, 27, 29].
십이지장 유두부 종양의 내시경 치료 성적
현재까지의 문헌 보고에 따르면 종양의 완전 절제는 한 두 차례의 내시경 시술로 90% 이상의 환자에서 가능하며, 5년 추적 시 완전 관해율은 약 80%에 이른다[ 16, 24, 26, 35]. 기존의 보고를 토대로 살펴보면 내시경 유두 절제술의 국소 재발은 5-30%에서 발생하지만, 장기간 추적하더라도 유두부 선암이 발생하는 경우는 드물다. 따라서 유두부 선종의 약 70%는 내시경 시술만으로도 치료가 가능하다고 추정할 수 있다.
내시경 치료의 합병증
내시경 유두 절제술과 관련한 합병증은 급성 췌장염, 출혈, 천공, 및 담관염 등의 시술직후에 발생하는 합병증과 수주 또는 수개월 뒤에 발생하는 유두부 협착 등의 지연성 합병증으로 분류할 수 있다. 이 중 췌장염과 출혈이 가장 많은 빈도를 차지한다[ 32]. 기존 문헌에서 합병증 중 사망은 드물었고(0.09%), 유두 절제술 후 췌장염이 원인이었다[ 36]. 급성 출혈의 경우 보통 내시경 지혈술을 통해 치료가 가능하고 다량의 출혈이 내시경 지혈술로 해결이 안될 경우 색전술을 통한 지혈술이 가능하다. 보다 심각한 합병증인 십이지장 천공은 드물게 발생하지만 이차적으로 복막염으로 진행할 수 있기 때문에 때로는 치명적일 수 있다. 이는 큰 선종을 분할하여 절제하는 경우에 위험성이 증가한다. 시술 도중 천공된 부분이 육안으로 확인되지 않으나 우측 신장 주변의 후복막 공기 음영이 나타나면 천공으로 진단하고 최대한 내시경을 통한 송기를 적게 하고, 클립 등으로 천공을 봉합한 뒤 보존적 요법을 시행하면 대부분 조절이 가능하다. 그러나 시술 도중 복막이 보일 정도의 큰 천공이나 CT에서 복막염이 의심되는 천공은 적극적인 수술적 치료가 필요하다. 장기간 추적 중에 발생할 수 있는 합병증은 췌관 또는 담관의 협착이다. 이 역시 내시경을 이용한 풍선 확장술이나 스텐트 삽관으로 치료가 가능하다.
시술 후 추적 관찰
시술 후 추적 관찰의 기간과 간격에 대한 가이드라인은 없다. 내시경적 완전 절제 후 유두부 선종의 재발은 26%까지 보고 된다[ 27]. 증상이 없다면 내시경적 추적 관찰은 췌담도 조영술 없이 시행되며, 간격은 조직학적 소견, 절제 변연 부위상태, 유전성 용종 증후군의 과거력, 나이 등에 따라 다양하다. 잔여 병변이 없다면 시술 후 추적 내시경은 3개월 후 시행하고, 이때 재발이 없다면 1년 후 추적 관찰이 합리적일 것이다. 이 이후 추적관찰에 대해서는 알려진 가이드라인은 없고, 다만 환자가 가족성 선종성 용종 환자라면 매 3년마다 내시경 추적 관찰을 권한다.
결 론
십이지장 유두부 종양은 증상이 없이 발견되는 경우가 많으며, 선종의 경우 악성 변화가 가능하기 때문에 임상적으로 간과되어서는 안된다. 특히 최근 내시경초음파와 관강내 세경 초음파 검사의 보급에 따라 십이지장 유두부 종양의 보다 정밀한 평가가 가능해짐으로써 적절한 치료법을 선택하는 것이 매우 중요해졌다. 또한 내시경 유두 절제술은 유두부 선종의 최선의 치료법이지만 적응증이 엄격하고 간과할 수 없을 만큼의 시술과 관련된 합병증의 위험성이 존재한다. 따라서 실제 시술을 시행하기 전에 본 고에서 기술한 유두부 종양의 진단에 있어서 내시경의 역할과 한계, 내시경 유두절제술의 기본적인 방법 및 치료 시 고려해야 할 사항에 대한 숙지가 반드시 선행되어야 한다.
REFERENCES
1. Avisse C, Flament JB, Delattre JF. Ampulla of Vater. Anatomic, embryologic, and surgical aspects. Surg Clin North Am 2000;80:201-212.   2. Keddie NC, Taylor AW, Sykes PA. The termination of the common bile duct. Br J Surg 1974;61:623-625.   3. Grobmyer SR, Stasik CN, Draganov P, et al. Contemporary results with ampullectomy for 29 “benign” neoplasms of the ampulla. J Am Coll Surg 2008;206:466-471.   4. Rosenberg J, Welch JP, Pyrtek LJ, et al. Benign villous adenomas of the ampulla of Vater. Cancer 1986;58:1563-1568.   5. Scarpa A, Capelli P, Zamboni G, et al. Neoplasia of the ampulla of Vater. Ki-ras and p53 mutations. Am J Pathol 1993;142:1163-1172.   6. Baczako K, Buchler M, Beger HG, et al. Morphogenesis and possible precursor lesions of invasive carcinoma of the papilla of Vater: epithelial dysplasia and adenoma. Hum Pathol 1985;16:305-310.   8. Sakorafas GH, Friess H, Dervenis CG. Villous tumors of the duodenum: biologic characters and clinical implications. Scand J Gastroenterol 2000;35:337-344.   10. Jagelman DG, DeCosse JJ, Bussey HJ. Upper gastrointestinal cancer in familial adenomatous polyposis. Lancet 1988;1:1149-1151.   11. Kadmon M, Tandara A, Herfarth C. Duodenal adenomatosis in familial adenomatous polyposis coli. A review of the literature and results from the Heidelberg Polyposis Register. Int J Colorectal Dis 2001;16:63-75.   12. Offerhaus GJ, Giardiello FM, Krush AJ, et al. The risk of upper gastrointestinal cancer in familial adenomatous polyposis. Gastroenterology 1992;102:1980-1982.  13. Dupas JL, Marti R, Capron JP, et al. Villous adenoma of the duodenum. Endoscopic diagnosis and resection. Endoscopy 1977;9:245-247.   14. Seifert E, Schulte F, Stolte M. Adenoma and carcinoma of the duodenum and papilla of Vater: a clinicopathologic study. Am J Gastroenterol 1992;87:37-42.  15. Ito K, Fujita N, Noda Y. Endoscopic diagnosis and treatment of ampullary neoplasm (with video). Dig Endosc 2011;23:113-117.   16. Binmoeller KF, Boaventura S, Ramsperger K, et al. Endoscopic snare excision of benign adenomas of the papilla of Vater. Gastrointest Endosc 1993;39:127-131.  17. Roggin KK, Yeh JJ, Ferrone CR, et al. Limitations of ampullectomy in the treatment of nonfamilial ampullary neoplasms. Ann Surg Oncol 2005;12:971-980.   18. Chen CH, Yang CC, Yeh YH, et al. Reappraisal of endosonography of ampullary tumors: correlation with transabdominal sonography, CT, and MRI. J Clin Ultrasound 2009;37:18-25.   19. Cannon ME, Carpenter SL, Elta GH, et al. EUS compared with CT, magnetic resonance imaging, and angiography and the influence of biliary stenting on staging accuracy of ampullary neoplasms. Gastrointest Endosc 1999;50:27-33.   20. Rosch T, Braig C, Gain T, et al. Staging of pancreatic and ampullary carcinoma by endoscopic ultrasonography. Comparison with conventional sonography, computed tomography, and angiography. Gastroenterology 1992;102:188-199.
21. Ito K, Fujita N, Noda Y, et al. Preoperative evaluation of ampullary neoplasm with EUS and transpapillary intraductal US: a prospective and histopathologically controlled study. Gastrointest Endosc 2007;66:740-747.   22. Itoh A, Goto H, Naitoh Y, et al. Intraductal ultrasonography in diagnosing tumor extension of cancer of the papilla of Vater. Gastrointest Endosc 1997;45:251-260.   23. Menzel J, Hoepffner N, Sulkowski U, et al. Polypoid tumors of the major duodenal papilla: preoperative staging with intraductal US, EUS, and CT--a prospective, histopathologically controlled study. Gastrointest Endosc 1999;49:349-357.   24. Desilets DJ, Dy RM, Ku PM, et al. Endoscopic management of tumors of the major duodenal papilla: Refined techniques to improve outcome and avoid complications. Gastrointest Endosc 2001;54:202-208.   25. Suzuki K KU, Murakami Y. Two cases with ampullary cancer who underwent endoscopic excision. Prog Dig Endosc 1983;23:236-239.
26. Zadorova Z, Dvofak M, Hajer J. Endoscopic therapy of benign tumors of the papilla of Vater. Endoscopy 2001;33:345-347.   27. Cheng CL, Sherman S, Fogel EL, et al. Endoscopic snare papillectomy for tumors of the duodenal papillae. Gastrointest Endosc 2004;60:757-764.   28. Vogt M, Jakobs R, Benz C, et al. Endoscopic therapy of adenomas of the papilla of Vater. A retrospective analysis with long-term followup. Dig Liver Dis 2000;32:339-345.   29. Kahaleh M, Shami VM, Brock A, et al. Factors predictive of malignancy and endoscopic resectability in ampullary neoplasia. Am J Gastroenterol 2004;99:2335-2339.   30. Aiura K, Imaeda H, Kitajima M, et al. Balloon-catheter-assisted endoscopic snare papillectomy for benign tumors of the major duodenal papilla. Gastrointest Endosc 2003;57:743-747.   31. Bohnacker S, Seitz U, Nguyen D, et al. Endoscopic resection of benign tumors of the duodenal papilla without and with intraductal growth. Gastrointest Endosc 2005;62:551-560.
32. Standards of Practice C, Adler DG, Qureshi W, et al. The role of endoscopy in ampullary and duodenal adenomas. Gastrointest Endosc 2006;64:849-854.   33. Catalano MF, Linder JD, Chak A, et al. Endoscopic management of adenoma of the major duodenal papilla. Gastrointest Endosc 2004;59:225-232.   34. Harewood GC, Pochron NL, Gostout CJ. Prospective, randomized, controlled trial of prophylactic pancreatic stent placement for endoscopic snare excision of the duodenal ampulla. Gastrointest Endosc 2005;62:367-370.
35. Norton ID, Gostout CJ, Baron TH, et al. Safety and outcome of endoscopic snare excision of the major duodenal papilla. Gastrointest Endosc 2002;56:239-243.
36. Keenan J, Mallery S, Freeman ML. EUS rendezvous for pancreatic stent placement during endoscopic snare ampullectomy. Gastrointest Endosc 2007;66:850-853.  
Fig. 1.
Endoscopic appearance of various ampullary tumors. (A) Ampullary adenoma, (B) choledochocele. (C) Separate orifice of bile duct and pancreatic duct. (D) Ampullary cancer. (E) Ampullary cancer and (F) unexposed type of ampullary cancer. 
Fig. 2.
The role of Endoscopic ultrasound (EUS) and IDUS for ampullary tumor. (A) Endoscopic appearance of ampullary cancer. (B, C) Red arrow; Distal common bile duct invasion of tumor on EUS. (D) Common bile duct and main pancreatic duct invasion revealed by IDUS. 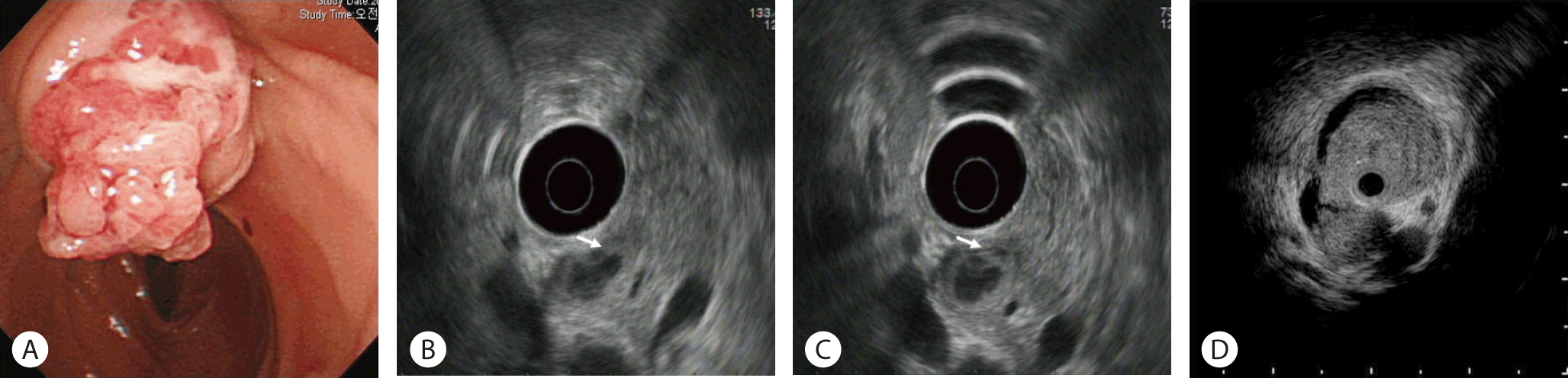
Fig. 3.
Endoscopic papillectomy. (A) 2 cm sized flat adenoma on ampulla of Vater. (B) Normal appearance of common bile duct and main pancreatic duct on endoscopic retrograde cholangiopancreatography (ERCP). (C) Endoscopic snaring of ampullary mass. (D, E) Selective cannulation and guidewire insertion into main pancreatic duct. (F) Placement of plastic stent in main pancreatic duct. 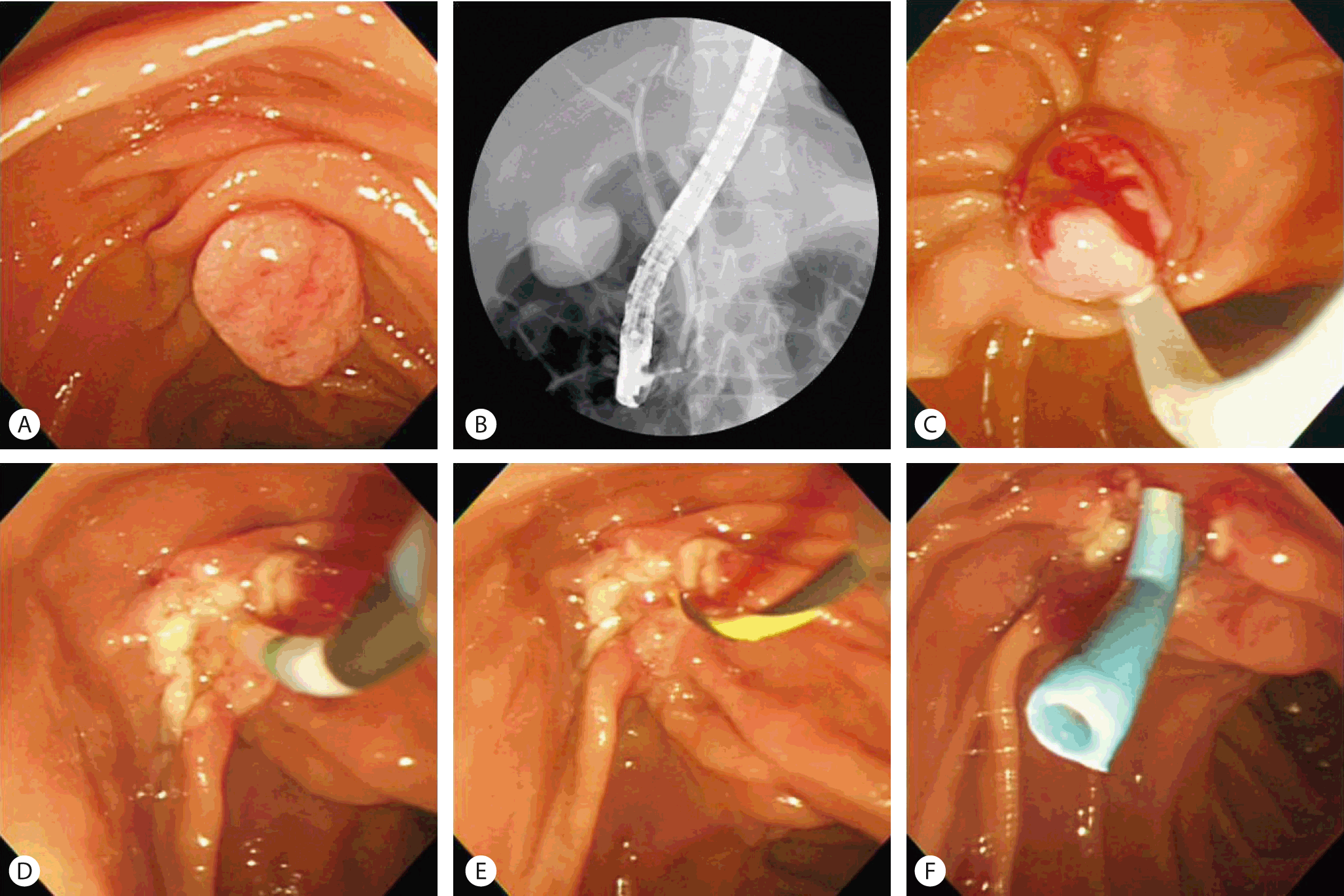
|
|















