서 론
융모막암(choriocarcinoma)은 난소, 고환, 자궁 등의 생식기관에 주로 발현되는 악성 종양으로 대부분 태반에서 융합세포영양막(syncytiotrophoblast)이 비정상적으로 증식하여 발생하며 주변조직으로의 침범 및 원격전이를 잘 하는 특징을 가진 종양으로 알려져 있다. 많은 경우에서 정상임신이나, 유산, 자궁 외 임신, 포상기태와 관련되어 발생하며 융모막암이 생식기관 이외에서 발생하는 경우는 흔치 않다[1]. 생식기관 이외에서 발생하는 경우 분화전능성 생식세포(totipotential germ cell)에서 발생하는 것으로 추정되며, 종격동, 후복막, 송과체 등 신체의 중앙 부위에 주로 발생하는 것으로 알려져 있고 유방, 간, 위, 대장, 폐, 췌장 등에서도 발생된 경우가 보고된 바 있다[2]. 특히 다발성 전이를 동반한 췌장 기원의 융모막암은 보고된 예가 많지 않아 초기에 진단의 어려움을 겪을 수가 있다. 저자들은 생식기관에 원발 병소 없이 간, 폐, 뇌의 다발성 전이 병변을 보이며 급성 췌장염과 뇌출혈을 동반한 췌장 융모막암 환자를 경험하였기에 문헌고찰과 함께 증례 보고하는 바이다.
증 례
47세 여자 환자가 내원 당일 발생한 두통 및 전신 쇠약감, 좌측 반맹의 시야결손으로 본원 응급실로 내원하였다. 환자는 기저질환 없이 건강히 지내던 분으로 최근 2주 전부터 원인미상의 상복부 통증 및 오심, 식욕감소가 있었으며 그 외 증상은 호소하지 않았다. 흡연과 음주는 하지 않았고, 자녀는 3명으로 18년 전 마지막 출산 이후 자궁 외 임신이나 유산 등의 병력은 없었다. 폐경은 되지 않았으나 내원 수개월 전부터 생리가 불규칙하였다고 하며, 남편과 환자에게 확인하였을 때 임신 가능성은 전혀 없는 상태였다.
내원 당시 활력징후는 혈압 136/83 mmHg, 맥박수 82회/분, 호흡수 20회/분, 체온은 36.7℃였으며, 의식은 명료하였다. 신체 검진에서 대광반사는 양측에서 직, 간접 모두 잘 관찰되었고 안저의 유두부종은 관찰되지 않았으며 근골격계 운동 마비 및 감각 이상은 관찰되지 않았다. 상복부에 압통이 관찰되었고 장음은 저하되어 있었으나 그 외 특이소견은 관찰되지 않았다.
일반혈액검사에서 백혈구 7,100/mm3 (호중구 66.6%), 혈색소 12.7 g/dL, 혈소판은 123,000/mm3였다. 생화학검사에서 혈중요소질소 8.0 mg/dL, 크레아티닌 0.52 mg/dL, 공복혈당은 89 mg/dL, 나트륨 138 mmol/L, 칼륨 3.7 mmol/L, 염소 101 mmol/L, 총 단백 7.0 g/dL, 알부민 3.7 g/dL, 아스파르테이트아미노전달효소 34 IU/L, 알라닌아미노전달효소 34 IU/L, 총 빌리루빈 0.5 mg/dL, 젖산탈수소효소 253 IU/L, C-reactive protein 1.20 mg/L, 아밀라아제 206 U/L, 리파아제 389 U/L였다. 응고 검사는 Prothrombin time 12.5 sec, Partial thromboplastin time 33.4 sec였고 종양표지자 검사에서 Carcinoembryonic antigen는 0.83 ng/mL, CA 19-9 10.78 U/mL로 정상범위 이내였다.
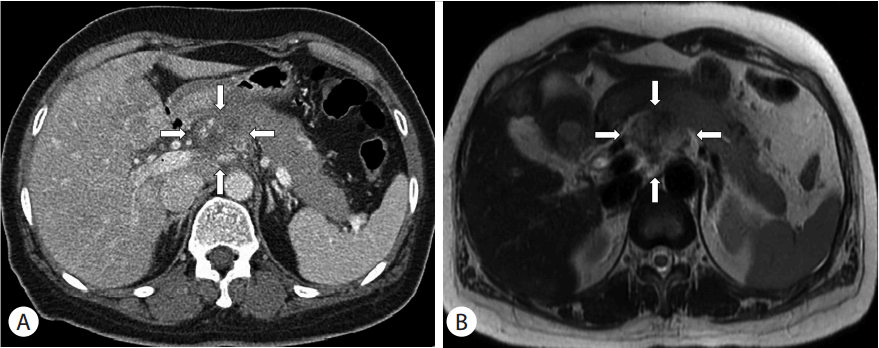
복부 컴퓨터단층촬영(computed tomography)에서 췌장의 체부에 복강동맥을 둘러싸는 3.1 × 2.5 × 3.4 cm 크기의 경계가 불분명한 종괴가 관찰되었고(Fig. 1A), 종괴의 압박으로 인해 주췌관의 확장 및 췌장 미부 실질의 부종이 관찰되어 있었다. 총간관(common hepatic duct) 주변에 췌장 종괴와 인접한 종괴가 관찰되었으며 중심부 괴사 및 가장자리가 강하게 조영증강되어 전이성 림프절로 추정되었다. 불균일하게 조영증강되는 다발성 저음영 종괴들이 간의 양엽에서 관찰되고 간문맥의 혈전이 동반되어 췌장 종괴의 혈행성 전이 병변으로 의심되었다. 하복부의 생식기관에는 특이소견이 관찰되지 않았다. 가돌리늄 조영증강 복부 자기공명영상(magnetic resonance imaging)에서 췌장 종괴는 약 3.2 cm로 T2 강조영상에서 불균질한 저신호강도를 보였으며 췌장 밖으로 침윤소견을 동반하고 있었으며 복부 컴퓨터단층촬영에서 총간관 주변부의 전이성 림프절로 추정되었던 종괴는 췌장 종양의 일부분인 것으로 확인되었다(Fig. 1B). 흉부 컴퓨터단층촬영에서 중심부 괴사를 동반한 약 1.9 cm 크기의 비균질적 음영을 보이는 결절이 우측 폐 상엽에서 관찰되었으며(Fig. 2A), 또한 1 cm 이하의 소결절들이 양측 폐에 다발성으로 관찰되어 혈행성 전이암이 의심되었다. 그 외 종격동에는 특이소견이 관찰되지 않았다. 뇌 자기공명영상에서 우측 두정엽에 1.2 cm 크기의 조영증강되는 종괴와 종괴주위 출혈 및 부종이 관찰되었다(Fig. 2B). 전신 양전자방출컴퓨터단층촬영(positron emission tomography- computed tomography)에서 췌장의 체부, 간의 양엽, 우측 뇌의 두정엽, 양측 폐에서 fluorodeoxyglucose의 섭취가 증가된 과대사 종괴들이 관찰되었으며(Fig. 2C) 췌장병변이 원발병소일 것으로 추정되었다. 이외 종격동, 생식기관, 소화기관에는 특이소견이 관찰되지 않았다.
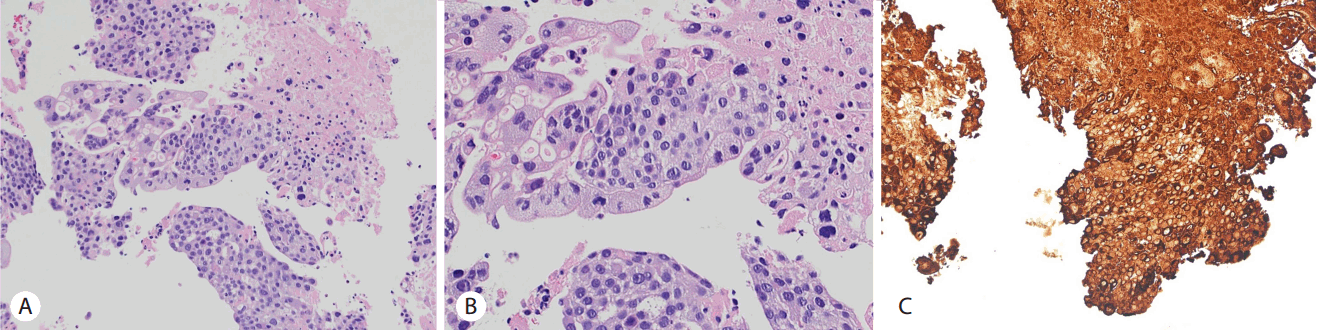
상기 검사결과에 근거하여 췌장기원 원발성 악성 종양이 간, 폐, 뇌로 전이 되었으며 종양으로 인한 이차성 췌장염 및 뇌출혈 발생 상태로 초기 진단하고 이에 대한 보존적 치료를 시행하였다. 영상검사에서 췌장 선암의 다발성 장기 전이가 의심되었으나 CEA, CA19-9는 정상범위 이내로 조직학적 진단이 필요한 상황이었다. 급성 췌장염 및 뇌출혈이 동반된 상태로 내시경 역행성 담췌관조영술(endoscopic retrograde cholangiopancreatography)이나 내시경초음파 유도하 생검(endoscopic ultrasound-guided fine needle aspiration)은 시행이 어려울 것으로 판단되어 전이성 간종괴에서 초음파 유도하 조직검사를 시행하였다. 조직괴사로 인해 일부의 세포조직만 얻을 수 있었고 병리조직 결과 융모성선자극호르몬(β-hCG)에 강하게 염색되는 전형적인 영양막세포와 합포체영양세포(syncytiotrophoblast)로 구성된 이중 망상형(dimorphic plexiform)이 관찰되어 융모막암으로 진단할 수 있었다(Fig. 3). 조직병리결과 확인 후 혈액내 β-hCG를 측정하였고 225,000 mIU/mL 이상으로 매우 상승되어 있음을 확인하였다. 이에 조직병리결과 및 영상검사를 종합하였을 때 췌장에서 발생한 원발성 융모막암이 간, 폐, 뇌로 전이 되었으며 이로 인한 급성 췌장염과 뇌출혈이 발생한 것으로 진단되었다.
환자는 금식 및 수액요법, 만니톨, 스테로이드 등을 사용하여 보존적 치료를 지속하였으나 입원 11일째 뇌부종이 심해지고 입원 15일째 고나트륨혈증이 지속되어 사망하였다.
고 찰
융모막암은 악성 생식세포종(germ cell tumor)의 일종으로 99% 이상의 경우 임신과 연관되어 생식기관에서 발생하는 것으로 알려져 있다[1]. 공격적인 성질을 가진 암종으로 다발성 장기로 혈행성 전이를 잘 하고 자발적으로 β-hCG를 분비하는 특징을 보인다[3]. 임신과 연관되지 않고 생식기관 이외에서 발생하는 융모막암은 전체 융모막암의 1% 미만에 불과할 정도로 드물게 관찰되며, 이 경우 대부분 종격동, 후복막, 송과체등 신체의 중앙에 있는 구조물에서 호발하고 특히 전종격동(anterior mediastinum)에서 가장 잘 발생하는 것으로 알려져 있다[2]. 그러나 뇌, 폐, 유방, 간, 소화관(위, 소장, 대장), 신장, 부신, 방광, 전립선, 코 등에서도 원발성으로 발생된다는 보고들이 있고 췌장에서 원발성으로 발생한 경우도 드물게 보고되어 있다[4].
융모막암이 생식기관 이외에서 발생하는 기전은 명확히 알려져 있지 않으나 위, 폐의 융모막암에 대하여 보고한 Sears [5]가 제시한 가설을 통해 유추해 볼 수 있을 것으로 보인다. 첫째 배아형성과정(embryogenesis)에서 원시배아세포들(primordial germ cells)이 잘못 이동하여 생식기관 이외에서 존재하다가 악성화된 경우, 둘째 영양배엽 색전(trophobalstic emboli)에 의해 생식기관 이외로 세포들이 이동된 후 악성화하는 경우, 셋째 생식기관에서 발생한 원발성 융모막암은 퇴화하고 전이된 병변만 남게 되는 경우, 넷째 분화도가 좋지 않은 상피세포암이 발생된 후 탈분화 과정을 거쳐 융모막암으로 화생(metaplasia)되는 경우, 다섯째 기존에 존재하던 기형종의 일부에서 융모막암이 발생하는 경우이다.
생식기관 이외에서 발생한 원발성 융모막암의 진단은 생식기관에 원발성 융모막암이 존재하지 않는 것이 확인되고, 혈중 β-hCG가 상승되며 종양의 조직병리검사에서 특징적인 영양막세포와 합포체영양세포로 구성된 이중 망상형(dimorphic plexiform)이 관찰되는 경우 진단할 수 있다. 융모막암은 전이된 장기에서 출혈을 잘 일으키는 것으로 알려져 있는데, 이는 영양막세포의 혈관친화성으로 인해 융모막암 내부의 신생혈관벽에 영양막세포가 침범하면 신생 혈관벽이 약화되고 이로 인해 동맥류 및 출혈이 발생하기 때문이다. 따라서 병변내에 괴사와 출혈이 잘 동반되기 때문에 전형적인 조직형태를 관찰하기 쉽지 않다. 본 증례의 경우도 간에 전이된 종괴에서 조직검사를 시행하였을 때 대부분의 조직이 괴사되어 일부의 세포만 관찰할 수 있었으나 전형적인 영양막세포와 합포체영양세포로 구성된 이중 망상형이 관찰되어 진단된 경우이다.
β-hCG는 융모막암의 특징적인 혈중 표지자이다. Yokoi 등[6]은 융모막암 환자의 96.4%에서 혈중 β-hCG가 상승됨을 보고하였으며 Jiang 등[7]은 β-hCG를 반복적으로 검사하여 융모막암의 치료반응을 평가할 수 있다고 하였다. Wei 등[8]은 혈중 β-hCG가 높을수록 더 나쁜 예후와 연관성이 있을 것으로 제안하였으나 이에 대해서는 좀 더 명확한 연구가 필요한 상태이다.
생식기관 이외에서 발생한 융모막암의 영상소견은 생식기관에서 발생한 융모막암과 유사하다. 컴퓨터단층촬영, 자기공명영상에서 과혈관성 종양의 특징인 동맥기의 점진적인 종괴 주변부 조영증강을 보이며, 종괴 내부에 출혈이나 괴사가 잘 동반되어 이로 인한 이차적인 변화를 관찰할 수 있다[9]. 고위험성 융모막암의 경우 전신 양전자방출컴퓨터단층촬영이 원발병소 및 전이병변을 확인하는데 도움이 될 수 있다[10]. Rao 등[11]은 여성 생식기관에 원발병소가 관찰되지 않았으나 혈중 β-hCG의 상승이 관찰된 28세 여자에서 전신 양전자방출컴퓨터단층촬영을 시행하여 췌장두부의 이상병변을 발견하고 췌장절제술을 시행하여 췌장두부에서 발생한 원발성 융모막암을 보고한 바 있다. 본 증례의 경우 생식기관 기원의 융모막암에 대한 직접적인 검사는 환자 상태가 악화되어 시행되지 못 하였으나, 환자 및 배우자에게 확인한 바에 의하면 최근 1년 이내 임신과 연관된 병력이 없었고 전신 양전자방출컴퓨터단층촬영에서 생식기관의 악성 종양을 의심할 만한 소견이 관찰되지 않아 생식기관 이외에서 발생한 융모막암으로 진단되었다. 다만 생식기관에서 발생한 원발병변이 소멸되었을 가능성은 배제할 수 없으나, 지금까지 원발병변이 퇴행을 보인 융모막암의 예는 증명되지 않았으며, 영상검사에서 발견되지 않을 정도로 매우 작은 원발병변이 췌장으로 전이된 경우 역시 보고된 바가 없어, 본 환자의 경우 영상검사와 조직병리결과를 종합하여 췌장에서 발생한 원발성 융모막암이 다발성 전이를 동반한 것으로 진단할 수 있었다. Ramachandran 등[12]은 급성 췌장염 및 가성낭종이 있는 환자에서 관찰된 췌장 종괴에서 초음파내시경유도하 세침흡입술을 시행하여 원발성 췌장 융모막암을 진단한 바 있다. 본 증례의 경우도 췌장 체부에서 발생한 종괴로 인해 급성 췌장염이 발생하였으며, 이와 동시에 우측 두정엽에 뇌출혈을 동반한 뇌전이로 인해 환자의 시야장애가 발생하고 동반된 뇌부종으로 의식저하가 발생하여 사망까지 이르게 된 경우이다.
임신과 관련되지 않은 생식기관 이외 융모막암의 치료는 아직 정립되어 있지 않다. 조기에 발견된 경우 병변의 절제가 가장 효과적일 것으로 받아들여지고 있으나 진단 당시 다발성 전이가 동반되어 있는 경우가 많아 수술이 불가능한 경우가 대부분이다[13]. Methotrexate 기반의 항암제에 잘 반응하는 임신성 융모막암과 달리 생식기관 이외에서 발생되는 융모막암의 경우 항암 치료에 대한 반응이 낮아 임신과 관련되지 않은 융모막암은 임신성 융모막암보다 좋지 않은 예후를 보인다. Cisplatin을 기본으로 하는 bleomycin, etoposide, cisplatin (BEP)나 vinblastin, ifosfamide, cisplatin (VIP), etoposide, methotrexate, actinomycin D, cyclophosphamide and vincristine (EMA-CO) 등의 복합항암화학요법을 시도할 수 있다[14]. 뇌전이가 동반된 경우는 화학요법과 방사선 치료를 시도해 볼 수 있고 두개강내 출혈로 인해 생명이 위협받는 경우는 수술을 시행할 수 있다. 대부분 전이된 병변의 출혈, 호흡부전, 출혈성 쇼크, 파종성혈관내 응고증후군, 복강구획 증후군(abdominal compartment syndrome) 등으로 인해 경과가 악화되며 특히 간전이나 뇌전이가 동반된 경우가 가장 나쁜 예후를 보인다[15].
결론적으로 조직괴사나 과혈관성 다발성 전이가 동반된 췌장 종괴가 관찰되는 경우 드물지만 생식기관 이외에서 발생한 융모막암의 가능성을 고려하여 β-hCG 측정 및 조직검사를 통해 가능한 빠른 시간 내에 융모막암을 감별하고 치료를 시작해야 한다. 또한 융모막암이 소아, 남성, 가임기 이후 여성에서도 발생할 수 있음을 숙지하고 있어야 한다.